Fanconi贫血(FA)是一种遗传性血液疾病,由22个已知基因的突变引起,这些基因编码的FA蛋白在DNA交联修复中起关键作用。FA患者常表现为造血干细胞(HSCs)迅速耗竭和骨髓衰竭。目前,唯一的治愈方法是同种异体骨髓移植,但存在供体匹配困难和移植相关风险等问题。因此,基因修复或添加疗法成为有吸引力的替代方案。
现有基因疗法主要集中于体外修饰HSCs后回输患者体内,但这种方法存在HSCs动员困难、体外传代过程中存活率低以及对传统预处理策略敏感等问题。本研究提出了一种新的体内蛋白替代疗法,即通过LNPs递送mRNA至体内,实现FA蛋白的体内表达,从而恢复HSPC功能。
01
材料与方法
1.1 材料:
- 实验动物:Fancc缺陷小鼠(Fancc-/-)及野生型(WT)小鼠,购自Jackson Laboratory。
- LNPs:由Acuitas Therapeutics提供,包含可离子化阳离子脂质、磷脂酰胆碱、胆固醇和聚乙二醇(PEG)脂质。
- mRNA:线性或环状Fancc mRNA,通过体外转录合成,并进行5'帽结构和3'多聚腺苷酸尾修饰。
1.2 方法:
- LNP制备与表征:将mRNA与LNPs按一定比例混合,通过旋转蒸发法制备LNP-mRNA复合物,并测定其粒径、zeta电位和RNA包封率。
- 动物实验:通过静脉注射(IV)或股骨内注射(IF)将LNP-mRNA复合物递送至小鼠体内。在不同时间点收集骨髓、脾脏和肝脏等组织,评估mRNA的转染效率和表达水平。
- 功能验证:通过集落形成实验评估LNP-mRNA处理对Fancc缺陷HSPCs增殖能力和烷基化剂抵抗性的影响。同时,通过流式细胞术分析HSPCs的免疫表型变化。
02
实验结果
2.1 增殖能力恢复:
通过集落形成实验评估了LNP-Fancc处理对Fancc缺陷HSPCs增殖能力的影响。结果显示,LNP-Fancc处理显著增加了Fancc缺陷HSPCs形成的集落数量(图1A-C, D-F)。这表明LNP-Fancc处理能够有效恢复Fancc缺陷HSPCs的增殖能力。
2.2 烷基化剂抵抗性恢复:
Fancc蛋白在DNA交联修复中起关键作用,因此Fancc缺陷细胞对烷基化剂(如丝裂霉素C,MMC)高度敏感。本研究通过评估LNP-Fancc处理对Fancc缺陷HSPCs烷基化剂抵抗性的影响,进一步验证了LNP-Fancc的功能恢复效果。
结果显示,LNP-Fancc处理显著提高了Fancc缺陷HSPCs对MMC的抵抗性(图1B-C, E-F)。这表明LNP-Fancc处理能够有效恢复Fancc缺陷HSPCs的DNA修复能力,从而增强其对烷基化剂的抵抗性。

Figure 1. In vitro delivery of FANCC LNPs to correct FA-deficient BM-derived HSPCs
2.3 递送效率比较:
本研究通过静脉注射(IV)和股骨内注射(IF)两种途径将LNP-mRNA复合物递送至Fancc缺陷小鼠(Fancc-/-)体内。结果显示,无论采用哪种注射方式,LNP-mRNA均能有效转染至小鼠骨髓(BM)细胞。相比IV注射,IF注射在骨髓中的转染效率更高。具体来说,IF注射后,注射侧股骨中LNP标记的细胞比例显著高于未注射侧股骨及脾脏等系统性分布组织(图2D-F)。这一结果表明,直接注射至骨髓腔能够更有效地将LNP-mRNA递送至目标细胞。

Figure 2. IF delivery of Cre-recombinase LNP to stably induce reporter expression
2.4 mRNA表达水平评估:
使用荧光报告基因mCherry和荧光素酶报告系统评估了mRNA在体内的表达水平。结果显示,IF注射后骨髓中mCherry的阳性细胞比例和平均荧光强度(MFI)均显著高于IV注射(图3A-D)。

Figure 3. IF vs. IV delivery of fluorescent reporter LNP
荧光素酶报告系统进一步证实了这一结果。IF注射后,注射侧股骨的荧光素酶活性显著高于未注射侧股骨及脾脏等组织(图4A-B, E-H)。这些结果表明,IF注射能够更有效地实现mRNA在骨髓中的表达。

Figure 4. In vivo LNPLFluc expression after IF or IV delivery
2.5 mRNA表达寿命分析:
为了评估mRNA在体内的表达寿命,本研究比较了线性mRNA和环状mRNA在骨髓细胞中的表达情况。结果显示,环状mRNA的表达寿命显著长于线性mRNA(图5E-F)。在体外实验中,使用荧光素酶报告系统监测了LNP-Fancc处理后的Fancc缺陷造血干祖细胞(HSPCs)中Fancc mRNA的表达寿命。结果显示,环状mRNA处理组细胞的荧光素酶活性在较长时间内保持较高水平(图5G-H),表明环状mRNA能够更有效地延长mRNA在体内的表达寿命。
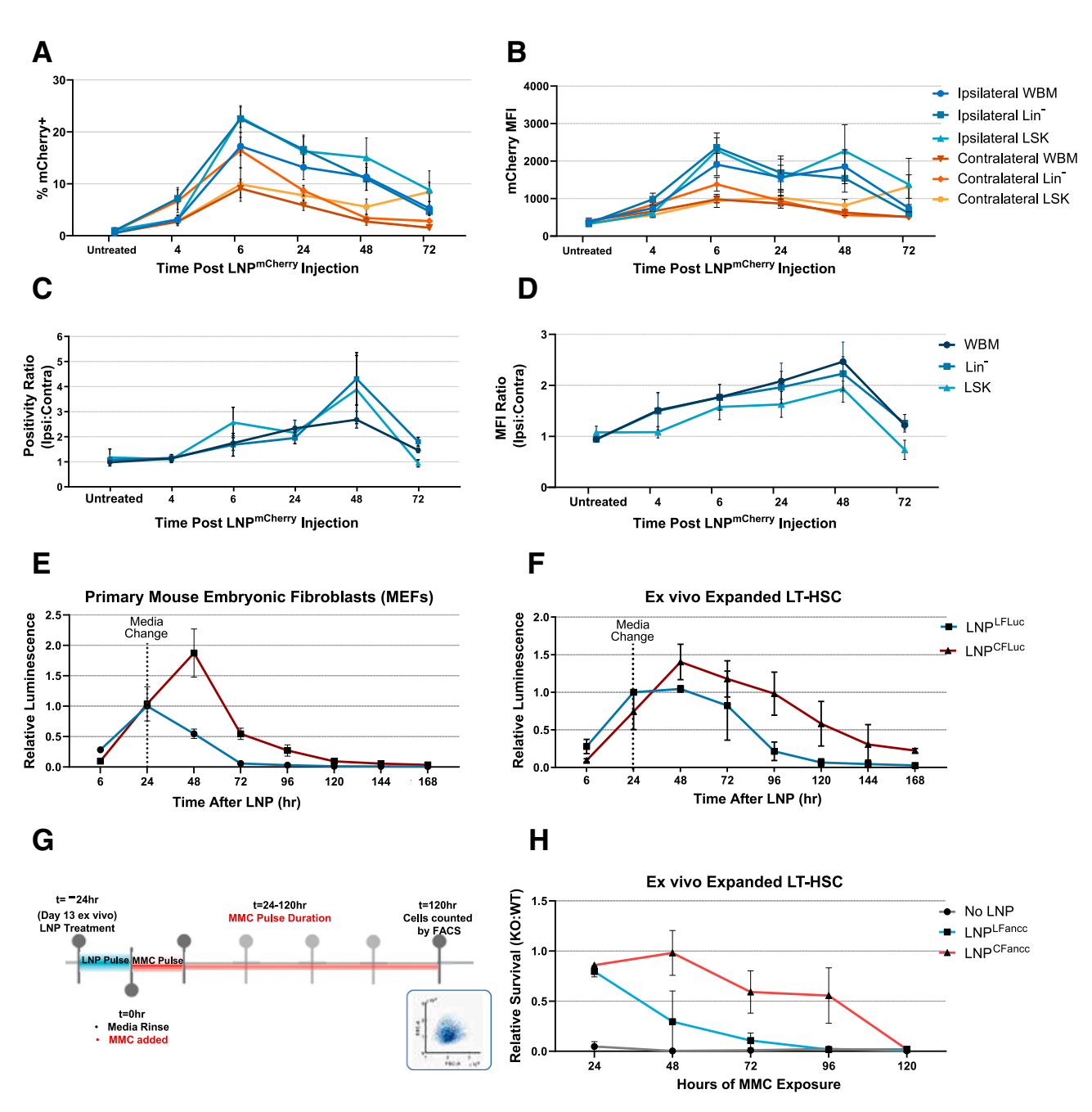
Figure 5. Functional lifetime of LNP mRNAs
2.6 免疫原性分析:
通过定量实时PCR分析了LNP处理对Fancc缺陷HSPCs免疫基因表达的影响。结果显示,尽管部分免疫相关基因的表达水平有所变化,但这些变化并未达到统计学显著性(图6A-B)。这表明LNP处理未引起显著的免疫原性反应,为LNP-mRNA疗法的临床应用提供了重要的安全性依据。

Figure 6. Immune screening of HSPCs after LNP treatment
2.7 重复给药效果:
为了评估重复给药对Fancc缺陷HSPCs功能恢复的影响,本研究在体外实验中进行了多次LNP-Fancc处理。结果显示,多次LNP-Fancc处理能够进一步提高Fancc缺陷HSPCs的增殖能力和烷基化剂抵抗性(图7A-C)。
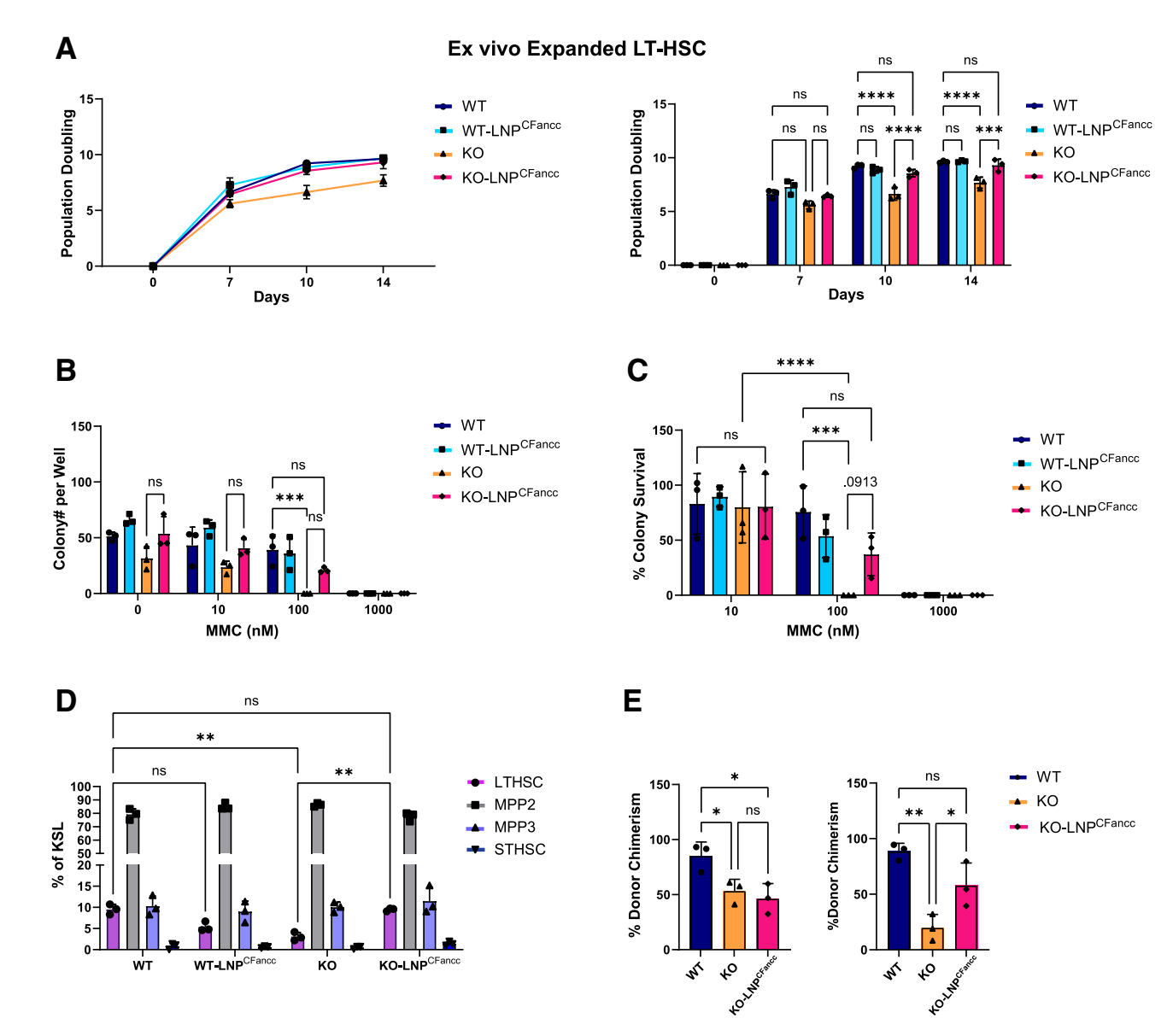
Figure 7. Impact of LNPCFancc on Fancc–/– HSPC in vitro proliferation and engraftment potential
综上所述,本研究通过LNPs递送mRNA至Fancc缺陷小鼠体内,成功实现了Fancc蛋白的体内表达,并显著恢复了Fancc缺陷HSPCs的增殖能力和烷基化剂抵抗性。同时,LNP处理未引起显著的免疫原性反应,为FA的临床治疗提供了新的策略。
03
讨论
本研究通过LNPs递送Fancc mRNA至Fancc缺陷小鼠体内,成功恢复了HSPCs的功能。这种体内蛋白替代疗法为FA的临床治疗提供了新的策略。与体外基因疗法相比,体内递送mRNA具有操作简便、无需复杂基础设施和物流支持等优势。
然而,本研究仍存在一些局限性。首先,Fancc缺陷小鼠模型并未自然呈现骨髓衰竭表型,这限制了模型对FA病理生理过程的模拟能力。其次,mRNA的表达具有瞬时性,需要重复给药以实现持久疗效。未来的研究将探索更稳定的mRNA修饰策略以及优化给药方案以提高疗效。
04
结论
本研究通过LNPs递送mRNA成功恢复了Fancc缺陷小鼠HSPCs的功能,为FA的临床治疗提供了新的策略。未来的研究将进一步优化mRNA修饰策略、给药方案以及评估该疗法的长期疗效和安全性。
参考文献:Banda, O., Adams, S. E., Omer, L., Jung, S. K., Said, H., Phoka, T., ... & Kurre, P. (2025). Restoring hematopoietic stem and progenitor cell function in Fancc mice by in situ delivery of RNA lipid nanoparticles. Molecular Therapy: Nucleic Acids, 36, 1-12.


















