随着基因治疗领域的快速发展,mRNA疗法因其高效灵活、安全性良好和研发周期短等优势,成为治疗多种疾病的重要手段。然而,传统脂质纳米粒(LNP)-mRNA系统存在肝靶向性强但肝外递送效率低的问题,限制了其在肝外疾病治疗中的应用。本研究旨在通过创新设计,开发一种能够实现肝外组织高效转染的LNP-mRNA递送系统。本研究通过调控双层脂质(卵鞘磷脂ESM/胆固醇)与可电离脂质的摩尔比(RB/I),开发了一种具有脂质体形态的长循环脂质纳米粒(LNP)-mRNA递送系统。实验结果表明,当RB/I=4时,该系统呈现“固态核心+脂质双层”结构,显著降低了血浆蛋白吸附,延长了血液循环半衰期,并在脾脏和淋巴结实现了50-150倍的转染效率提升。本研究为拓展mRNA疗法在肝外疾病的应用提供了新策略。
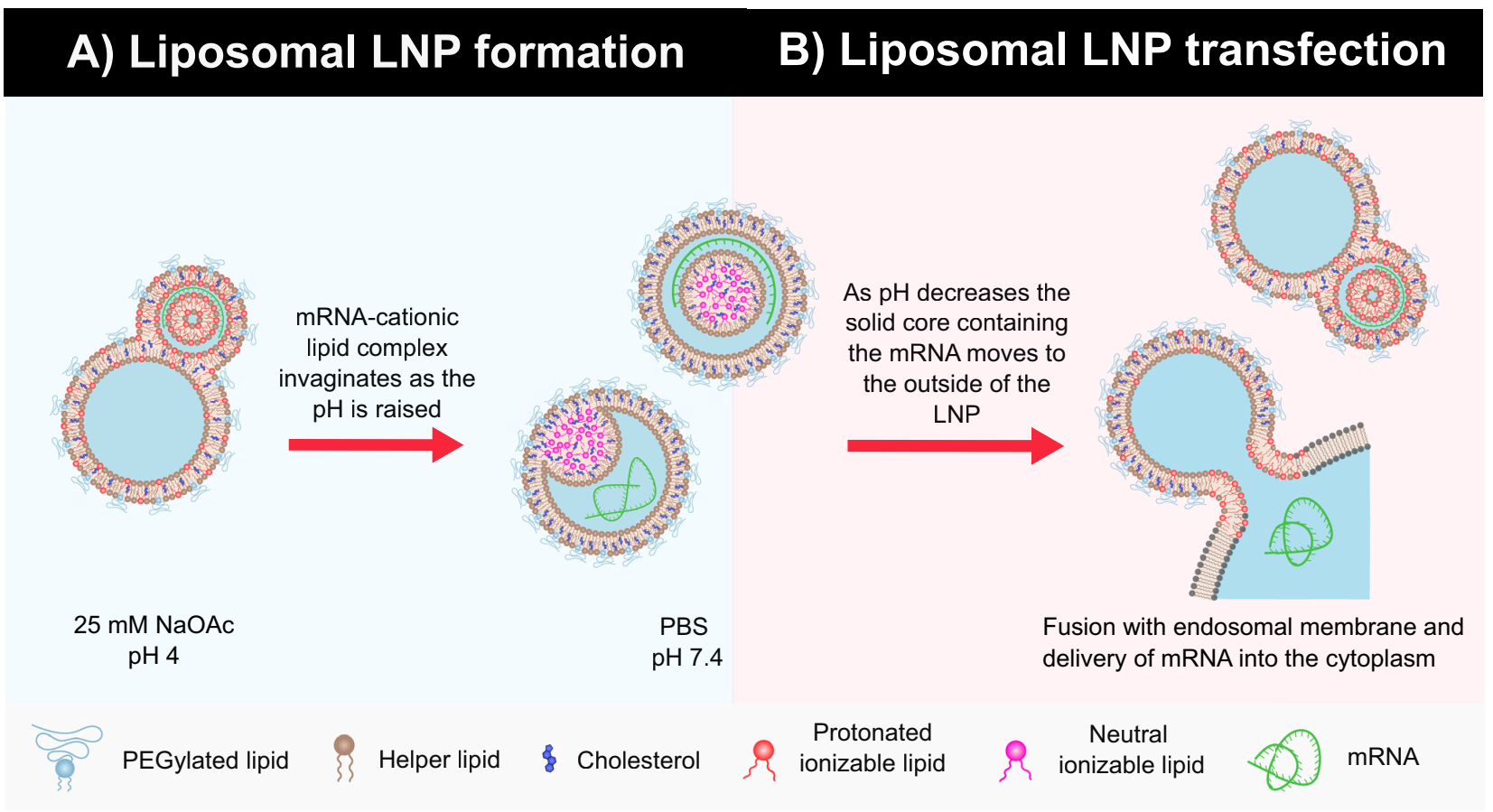
Model for the formation and transfection of liposomal LNP-mRNA systems.
01
材料
脂质:卵鞘磷脂(ESM)、胆固醇、可电离脂质(nor-MC3)、聚乙二醇化脂质(PEG-DMG)。
mRNA:编码NanoLuc荧光素酶的mRNA。
细胞系:人肝癌细胞系Huh7。
动物模型:CD-1小鼠。
02
方法
- LNP制备:通过微流控混合法,将脂质(ESM、胆固醇、可电离脂质、PEG-DMG)与mRNA在乙醇和缓冲液中混合,形成LNP。调控ESM/胆固醇与可电离脂质的摩尔比(RB/I)从9至0.43。
- 表征:使用冷冻电镜(cryo-TEM)解析LNP的纳米结构,动态光散射(DLS)测定粒径,BCA法测定蛋白吸附量,质谱分析蛋白冠组成。
- 体外转染实验:在Huh7细胞中评估不同RB/I的LNP转染效率。
- 体内实验:通过尾静脉注射LNP至CD-1小鼠,使用SPECT/CT成像追踪体内分布,评估脾脏、淋巴结等组织的转染效率。
03
实验结果
3.1 LNP的形态与结构:
通过冷冻电镜(cryo-TEM)对不同RB/I(双层脂质ESM/胆固醇与可电离脂质的摩尔比)的LNP进行观察,结果发现:
RB/I=4:在此比例下,约84%的LNP呈现出典型的脂质体结构,其核心为电子致密的固态结构,悬浮于水性腔室中,并被完整的脂质双层包裹。固态核心占据LNP内部空间的约30%,这一结构特征与预期相符,表明高比例的双层脂质有助于形成稳定的脂质体形态。
RB/I降低:随着RB/I值的降低,LNP的形态逐渐发生变化。当RB/I降至2.3及以下时,LNP开始呈现出部分脂质双层包裹固态核心的结构,固态核心与脂质双层之间的界面变得模糊,部分区域可见固态核心直接暴露于水性环境中。这一现象表明,双层脂质的比例对LNP的形态具有决定性影响。
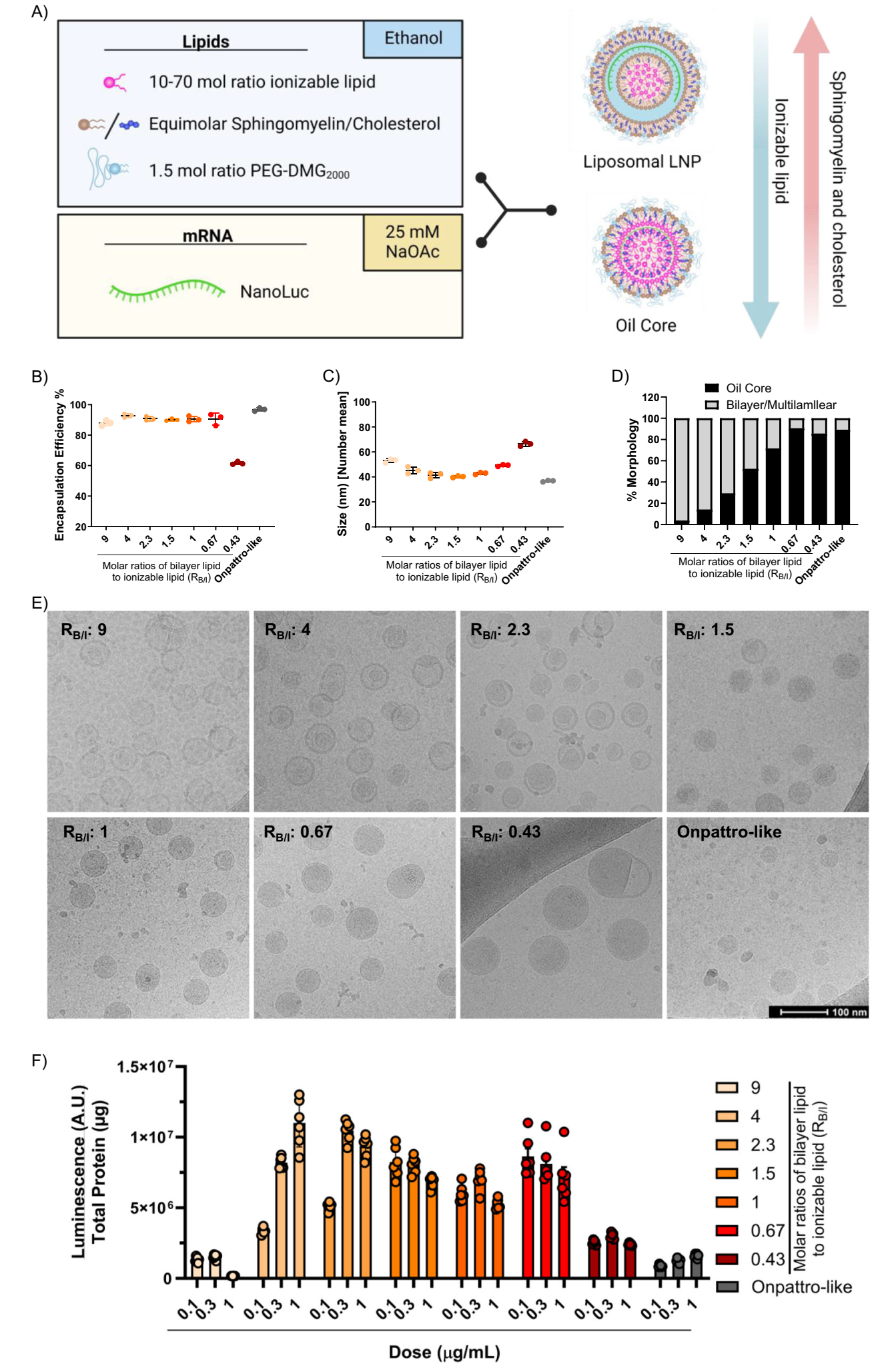
Fig. 1 | Morphological and in vitro transfection properties of LNP mRNA systems formulated using various bilayer lipid to ionizable lipid molar ratios (RB/I).
3.2 体外转染效率:
在Huh7细胞中评估不同RB/I的LNP转染效率,结果显示:
高效转染:RB/I=4-0.67的LNP在Huh7细胞中表现出高效的转染能力,其转染效率显著高于Onpattro样配方(RB/I≈1)。特别是在RB/I=4时,转染效率达到最优,这一结果验证了脂质体结构对提升转染效率的积极作用。
转染效率与形态的关系:转染效率与LNP的形态密切相关。具有完整脂质双层结构的LNP(RB/I=4)展现出最高的转染效率,而随着脂质双层结构的破坏(RB/I降低),转染效率也随之下降。这一发现进一步强调了脂质体结构在mRNA递送中的重要性。
3.3 体内分布与转染效率:
通过尾静脉注射LNP至CD-1小鼠,并使用SPECT/CT成像追踪体内分布,结果显示:
长循环特性:与Onpattro样配方相比,RB/I=4的脂质体LNP在血液循环中的半衰期显著延长(约15倍)。这一长循环特性归因于脂质体结构降低了血浆蛋白的吸附,从而减少了单核-巨噬细胞系统(MPS)的清除。
肝外组织转染:脂质体LNP在脾脏和腹股沟淋巴结的转染效率分别提高了50倍和150倍。此外,在心脏、乳腺、胰腺等组织中也观察到了显著的mRNA表达。这一结果表明,脂质体LNP具有广泛的组织分布能力,为实现肝外组织的mRNA递送提供了可能。
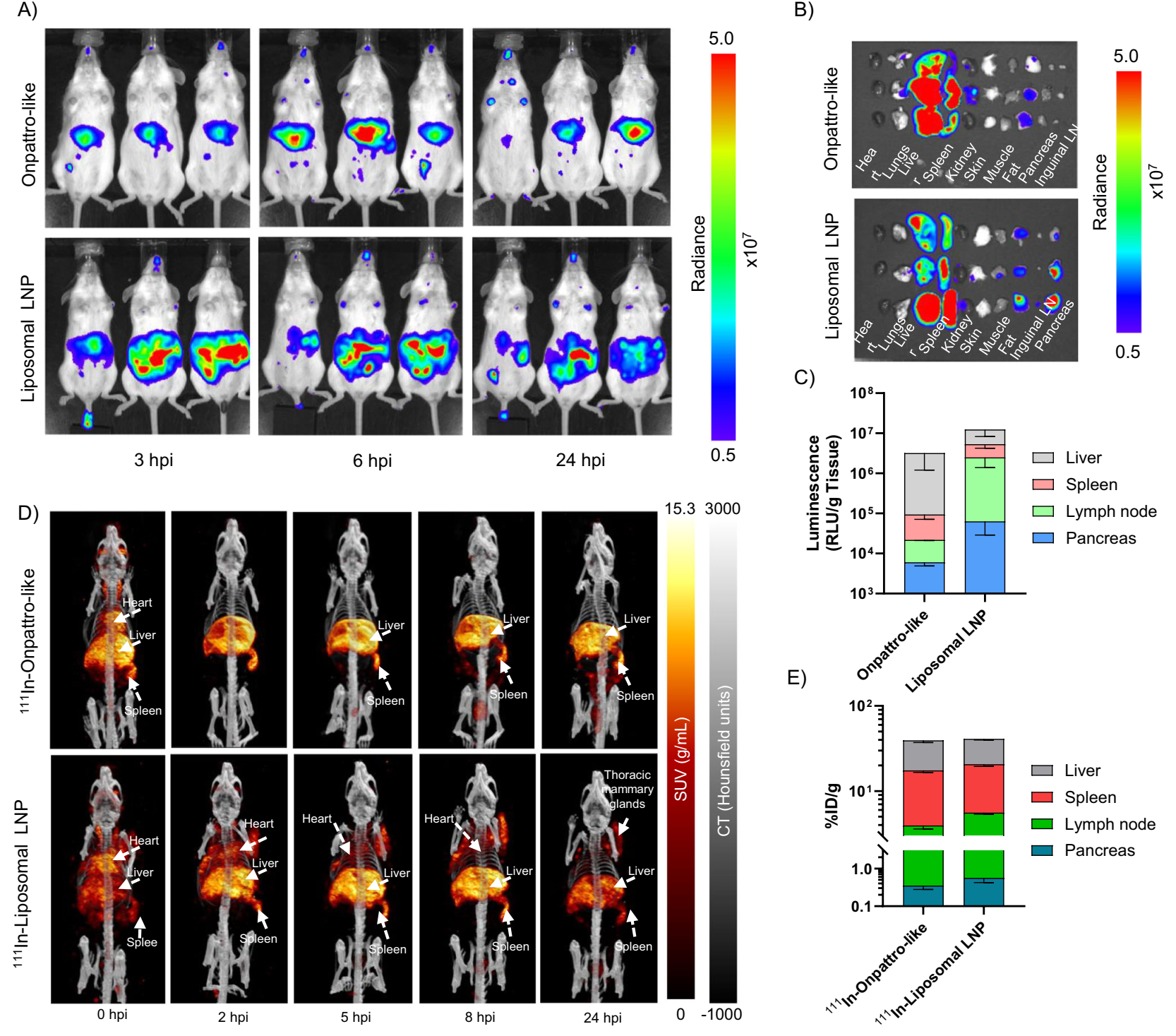
Fig. 2 | Liposomal LNP NanoLuc mRNA systems (RB/I = 4) exhibit enhanced lymphatic and pancreatic gene expression in vivo as compared to LNP with the Onpattro-like lipid composition.
3.4 蛋白冠分析:
通过质谱分析比较脂质体LNP与Onpattro样LNP的蛋白冠组成,结果显示:
蛋白总量减少:脂质体LNP的蛋白冠总量比Onpattro样LNP减少了约2倍。这一减少主要归因于脂质体结构降低了血浆蛋白的吸附。
特定蛋白吸附降低:在脂质体LNP的蛋白冠中,免疫球蛋白Ighv10-1和纤维蛋白原Fgb的吸附显著降低。这些蛋白的减少有助于降低MPS的识别和清除,从而延长LNP在血液循环中的时间。
蛋白组成变化:脂质体LNP的蛋白冠中,免疫蛋白比例减少了4.4%,而载脂蛋白比例增加了3.6%。这种组成变化可能有助于LNP在血液循环中的稳定性和靶向性。
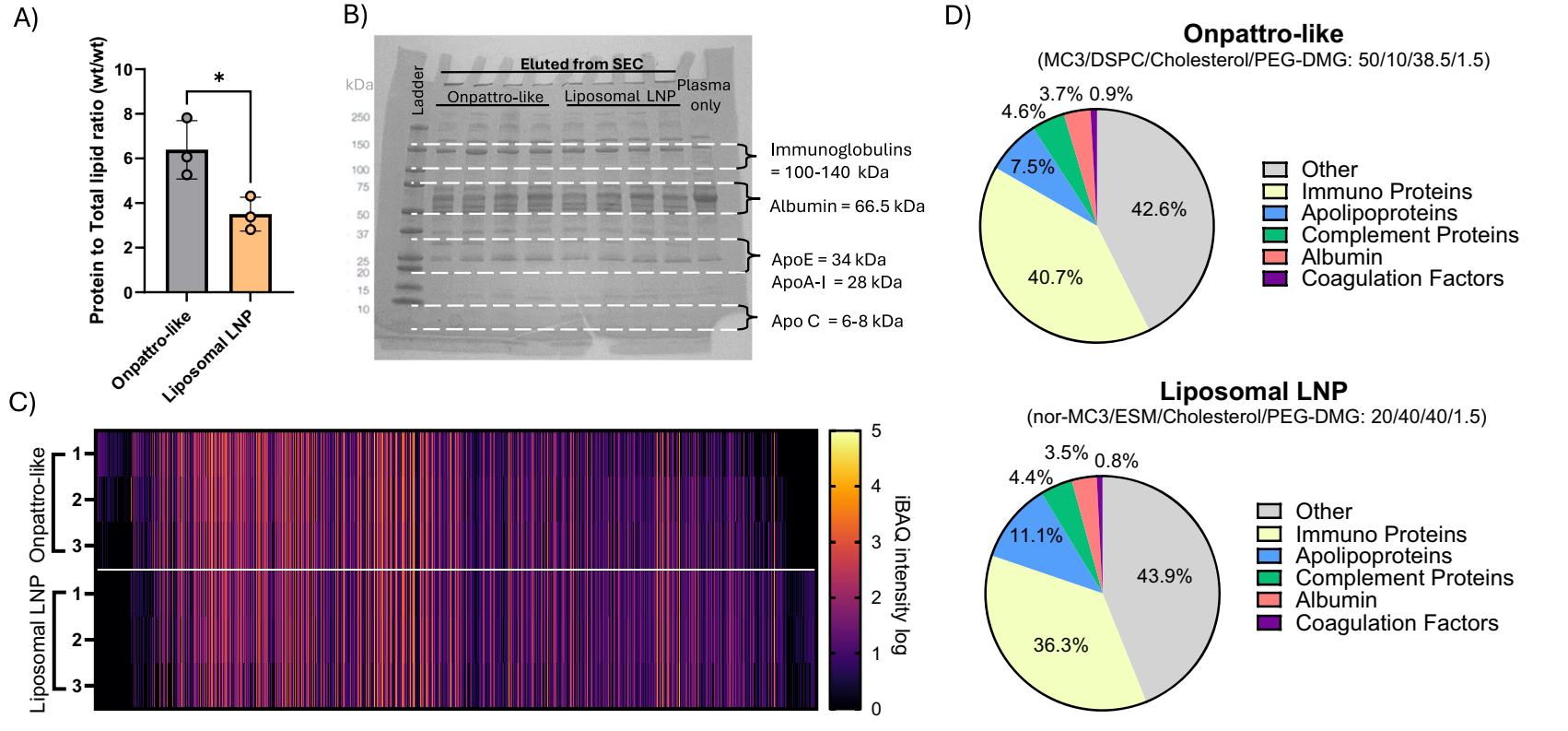
Fig. 3 | Liposomal LNP NanoLuc mRNA system exhibits a similar protein BMC profile but reduced total adsorbed protein compared to LNP with Onpattrolike lipid compositions.
3.5 包封和转染过程及相关机制:
在pH 4的条件下,将含有高比例双层脂质(如卵鞘磷脂ESM和胆固醇)与可电离脂质(如nor-MC3)的乙醇溶液与含有mRNA的25 mM醋酸钠缓冲液混合。在此过程中,可电离脂质在酸性条件下带正电,能够与带负电的mRNA通过静电相互作用形成复合物。随着乙醇的稀释和pH值的逐渐升高(通过透析至pH 7.4的PBS中),可电离脂质逐渐失去正电荷,变得更为疏水,并与双层脂质(ESM和胆固醇)共同组装成脂质体结构。在这一过程中,mRNA复合物被包裹在脂质体的内部水性腔室中,形成固态核心,并被脂质双层紧密包裹。通过调控双层脂质与可电离脂质的摩尔比(RB/I),可以优化脂质体的包封效率。实验结果显示,当RB/I=4时,包封效率达到90-100%,表明高比例的双层脂质有助于形成稳定的脂质体结构,从而有效包裹mRNA。
脂质体LNP通过内吞作用被细胞摄取,进入内体(endosome)。在这一过程中,脂质体的外层PEG脂质可能有助于减少与血浆蛋白的非特异性结合,从而提高细胞摄取效率。随着内体pH值的降低(从早期的pH 6.4到晚期的pH 5.6,再到溶酶体的pH 5),可电离脂质逐渐恢复正电荷,变得更为亲水,并倾向于从脂质双层中迁移至内体膜的内侧。这一过程导致脂质体结构发生变化,固态核心(包含mRNA复合物)被挤出至脂质体外部,形成突出的电子致密区域。挤出的固态核心(富含带正电的可电离脂质和mRNA复合物)与内体膜发生相互作用,促进膜融合。这一过程中,可电离脂质的正电荷与内体膜的负电荷之间的静电相互作用起到了关键作用。膜融合后,mRNA被释放到细胞质中,准备进行翻译。

Fig. 4 | Studies on the formation and intracellular delivery mechanisms of liposomal LNP mRNA systems.
04
讨论
本研究通过调控双层脂质与可电离脂质的摩尔比,成功开发了一种具有脂质体形态的长循环LNP-mRNA递送系统。该系统不仅显著降低了血浆蛋白吸附,延长了血液循环半衰期,还在脾脏和淋巴结等肝外组织中实现了高效的转染。这一突破为mRNA疗法在肝外疾病治疗中的应用提供了新的可能性。
未来的研究将进一步探索该系统在其他肝外组织中的转染效率,并优化LNP的配方和制备工艺,以提高其稳定性和安全性。
参考文献:Cheng, Miffy Hok Yan, et al. "Liposomal lipid nanoparticles for extrahepatic delivery of mRNA." Nature Communications 16.1 (2025): 4135.
















