

INano™ Optimux
多功能连续纳米药物制备系统(GMP)

INano™ L/L+
快速纳米药物制备系统

INano™ S
大规模商业化纳米药物制造系统

INano™ X
快速纳米药物制备系统

细胞转染试剂盒

应用试剂盒

器官靶向试剂盒

验证试剂盒

DNA试剂盒

蛋白试剂盒
“随着mRNA技术的快速发展,mRNA基治疗药物在多种疾病的治疗中展现出巨大潜力。然而,目前mRNA-LNPs的给药方式主要依赖于液体形式,如使用雾化器或高压气体将其雾化后给药。这种方式存在气道刺激、稳定性差等局限性。因此,开发mRNA-LNPs的粉末制剂具有重要意义。喷雾冻干技术作为一种无热制备粉末的方法,在药物制剂领域得到广泛应用。本研究通过pH调节的喷雾冻干技术,成功制备了适合吸入的mRNA-LNPs粉末,并对其理化性质、转染效率及体内外功能进行了评估。”
本研究旨在系统地探索多种赋形剂(包括寡糖、聚合物、氨基酸和各种缓冲液)对冻干mRNA-LNP(脂质纳米颗粒)质量和性能的影响。通过筛选45种不同冻干保护剂和缓冲液条件下的mRNA-LNP制剂,我们发现了以前未探索的制剂组合,如聚乙烯吡咯烷酮(PVP)在三羟甲基氨基甲烷(Tris)或醋酸盐缓冲液中,作为维持冻干mRNA-LNP理化稳定性的冻干保护剂新组合。此外,我们还深入研究了理化和结构属性如何影响冻干mRNA-LNP的功能性。
在本研究中,我们扩大了赋形剂的筛选范围,以研究它们对冻干mRNA-LNP质量和性能的影响。此外,通过利用高通量、多属性分析,我们旨在阐明理化和结构属性如何影响冻干mRNA-LNP的功能性。为此,我们评估了包括寡糖、聚合物和氨基酸在内的多种赋形剂,每种赋形剂在三种不同浓度下进行评估。此外,由于缓冲液的选择已被证明会影响mRNA-LNP的活性,我们还在筛选中纳入了三种不同的缓冲液,包括磷酸盐缓冲液(PBS)、Tris和酸性醋酸盐缓冲液。
3.1 冻干制剂的理化属性
我们评估了不同冻干保护剂和缓冲液条件下冻干mRNA-LNP的理化属性,包括粒径、mRNA的包封效率(EE)和mRNA完整性。结果表明,冻干保护剂和缓冲液类型均影响LNP中mRNA的EE。在冻干后EE变化保持在±10%以内的典型条件包括PBS中的10-20%蔗糖、醋酸盐中的5-10%蔗糖、醋酸盐中的10-20%麦芽糖以及Tris或醋酸盐中所有三种浓度的PVP-K12。
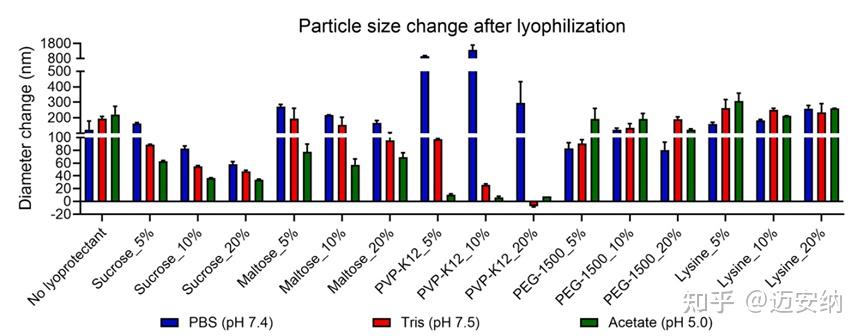 mRNA/LNP在不同冻干保护剂和缓冲液条件下冻干前后的包封率变化
mRNA/LNP在不同冻干保护剂和缓冲液条件下冻干前后的包封率变化
3.2 mRNA的完整性
mRNA的完整性对制剂性能有重大影响。为了研究冻干过程对mRNA完整性的潜在影响,我们从筛选的LNP制剂中提取了总mRNA,并使用毛细管凝胶电泳(CGE)测量了潜在降解。CGE结果显示,新鲜mRNA-LNP中总mRNA的78.5±1.2%是完整的。
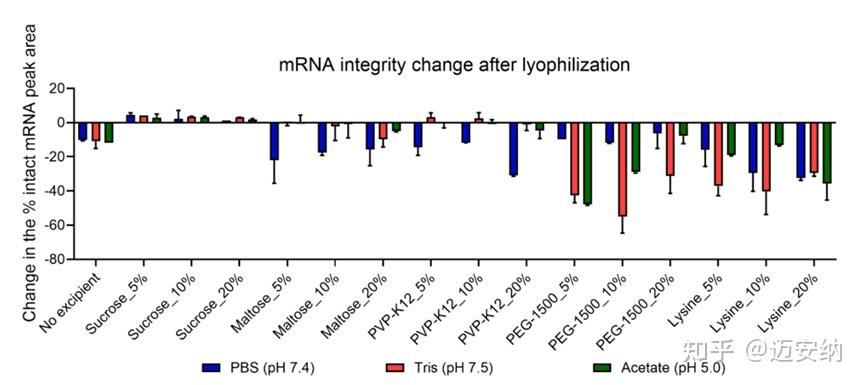 mRNA/LNP在不同冻干保护剂和缓冲液条件下冻干前后的mRNA完整性变化
mRNA/LNP在不同冻干保护剂和缓冲液条件下冻干前后的mRNA完整性变化
3.3 细胞活性及翻译效率
我们评估了冻干mRNA-LNP库在人单核细胞和HEK-293T细胞系中的体外活性。结果显示,与PBS相比,更多的冻干保护剂与Tris或醋酸盐缓冲液配对时,冻干mRNA-LNP的细胞活性得以维持。在PBS中,大多数冻干制剂的EGFP表达显著降低,而在Tris或醋酸盐缓冲液中,含PVP-K12的制剂显示出较高的EGFP表达。
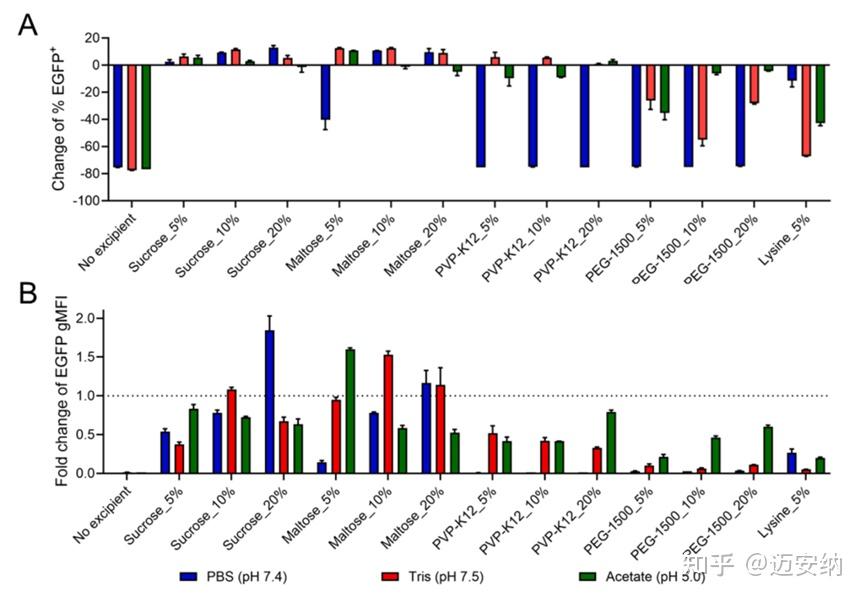 mRNA/LNP在不同冻干保护剂和缓冲液条件下冻干前后的细胞转染变化
mRNA/LNP在不同冻干保护剂和缓冲液条件下冻干前后的细胞转染变化
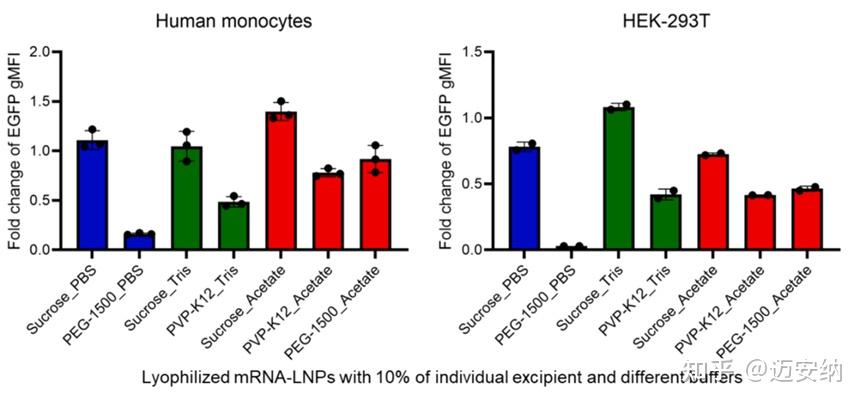 mRNA/LNP在不同冻干保护剂和缓冲液条件下冻干前后在human monocytes和HEK-293T细胞转染变化
mRNA/LNP在不同冻干保护剂和缓冲液条件下冻干前后在human monocytes和HEK-293T细胞转染变化
3.4 mRNA/LNP冻干前后不同理化性质变化和体外细胞转染的相关性
实验结果显示,虽然粒子大小的变化对体外细胞转染活性的影响不显著,但mRNA封装效率和完整性的降低以及LNP内部结构的无序化都是影响体外细胞转染活性的重要因素。这些结果强调了在冻干过程中保持mRNA-LNP理化性质稳定性的重要性,以确保其体外细胞转染效率。
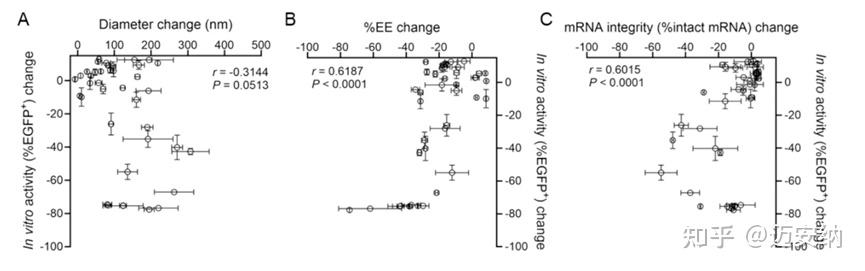
mRNA/LNP冻干前后不同理化性质变化和体外细胞转染的相关性
3.5 结构分析
使用高通量小角X射线散射(SAXS)和冷冻透射电子显微镜(cryo-TEM)分析了冻干mRNA-LNP的结构。结果显示,冻干后mRNA-LNP的结构发生了复杂的变化,包括有序核心结构的减少、bleb结构的出现以及高度无序结构与空泡的混合。缓冲液种类也影响了冻干后mRNA-LNP的结构特征,醋酸盐>Tris>>PBS的顺序对于冻干保护剂更好地维持mRNA-LNP的有序结构特征至关重要。
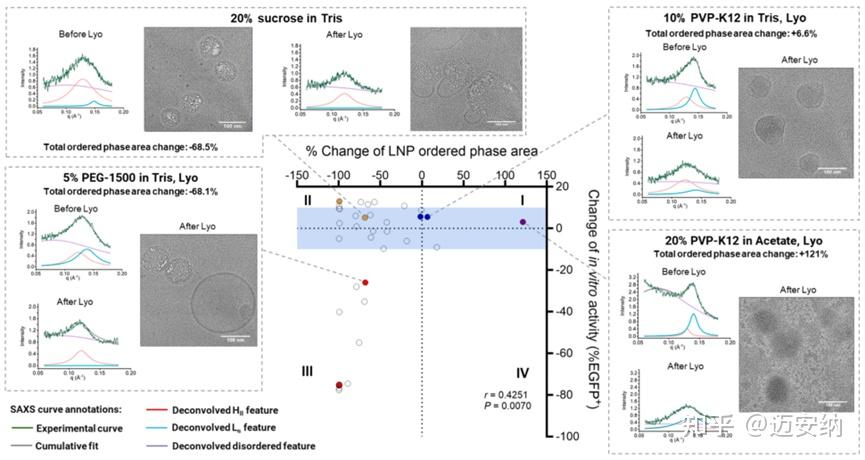 mRNA/LNP冻干前后结构变化和体外细胞转染变化的相关性
mRNA/LNP冻干前后结构变化和体外细胞转染变化的相关性
本研究首次对冻干mRNA-LNP的结构特征及其如何影响制剂功能性进行了深入调查,强调了mRNA-LNP结构与细胞活性之间的复杂关系。对于冻干mRNA-LNP,体外活性可以通过继承预冻干的有序核心特征以及通过精细结构特征(如囊泡生成与空泡的生成)的微调来维持。此外,本研究首次在扩大的制剂空间中对冻干mRNA-LNP进行了筛选,确定了有希望的制剂组合,如PVP-K12在三羟甲基氨基甲烷(Tris)或醋酸盐缓冲液中。这些发现为合理设计稳定的冻干mRNA-LNP制剂铺平了道路,并促进了这些制剂作为治疗药物的递送载体的发展。
参考文献:Fan, Yuchen, et al. "Physicochemical and structural insights into lyophilized mRNA-LNP from lyoprotectant and buffer screenings." Journal of Controlled Release 373 (2024): 727-737.
