

INano™ Optimux
多功能连续纳米药物制备系统(GMP)

INano™ L/L+
快速纳米药物制备系统

INano™ S
大规模商业化纳米药物制造系统

INano™ X
快速纳米药物制备系统

细胞转染试剂盒

应用试剂盒

器官靶向试剂盒

验证试剂盒

DNA试剂盒

蛋白试剂盒
“本研究介绍了一种安全有效的头颈癌(HNSCC)瘤内表皮生长因子受体(EGFR)靶向的CRISPR-脂质纳米颗粒(LNP)递送策略,用于共封装CRISPR-Cas9信使核糖核酸(mRNA)和单导向核糖核酸(sgRNA),以实现SOX2基因的敲除。我们生成了功能性靶向LNPs(tLNPs),它们共封装Cas9 mRNA与靶向SOX2的sgRNA,并涂覆有抗EGFR抗体。我们评估了它们在HNSCC癌细胞中的摄取和表达,以及体内外的治疗效果。结果显示,这些tLNPs能够特异性地靶向肿瘤细胞,诱导持久的治疗反应,为临床上高复发率的实体瘤如HNSCC提供了一种有前景的治疗方法。”
1.1 sgRNA筛选与基因编辑效率:
在本研究中,我们针对SOX2基因设计了三种sgRNA(sgSOX2-A、-B、-C),并在具有不同头颈癌原发起源的HNSCC细胞系(UMSCC-104和FADU)中进行了筛选。通过转染Cas9蛋白和针对SOX2的sgRNA(形成核糖核蛋白/RNP复合物)后,比较基因编辑效率。
Sanger测序和ICE分析结果显示,sgSOX2-A在UMSCC-104细胞系中实现了58%的体外基因编辑,在FADU细胞系中实现了40%的基因编辑。因此,sgSOX2-A被选为进一步体内和体外实验的最佳导向RNA。
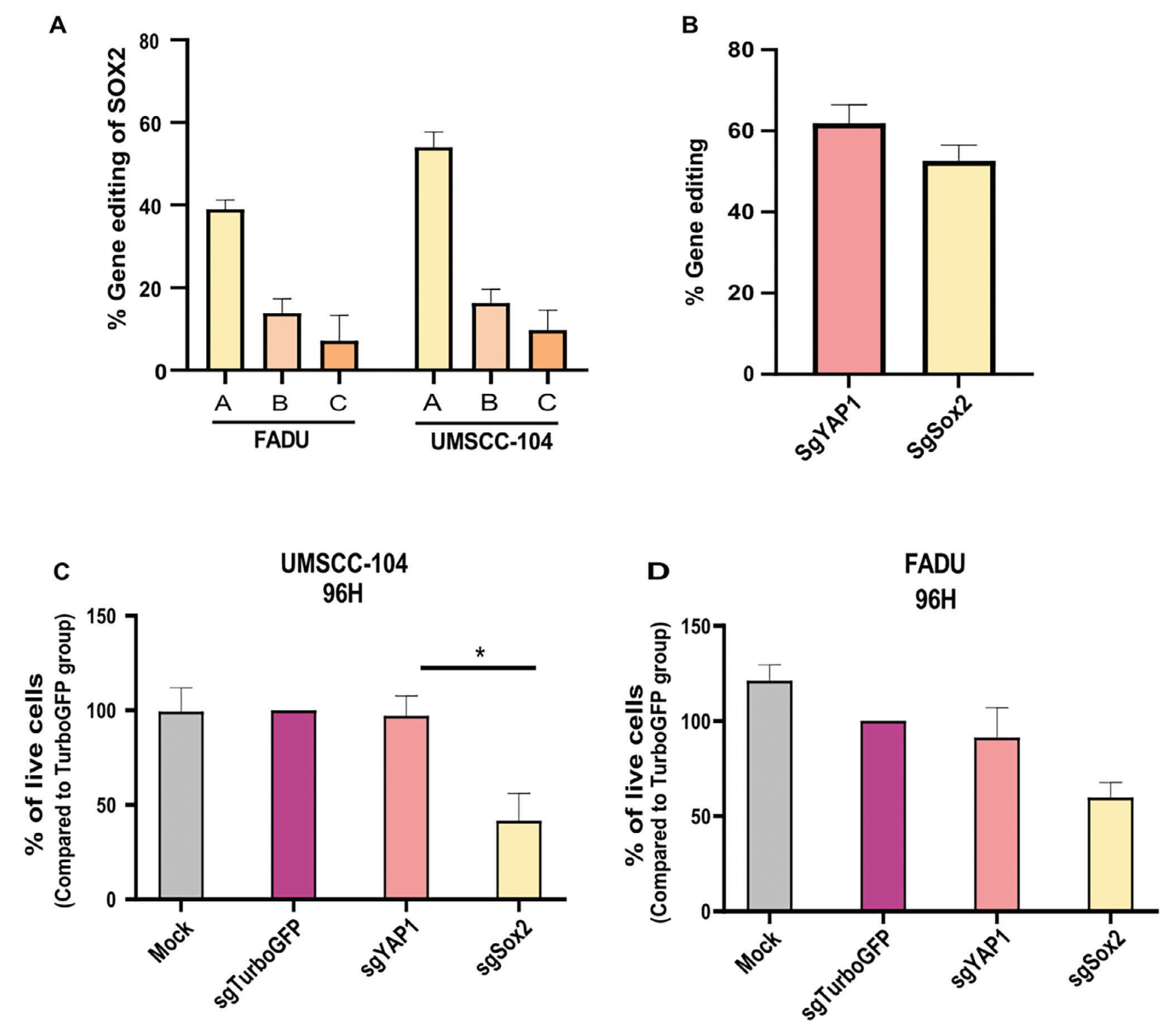
图一、sgRNA的体外筛选和细胞活性检测
1.2 基因编辑对细胞活性的影响:
为了评估基因编辑对细胞活性的影响,我们对转染了sgSOX2-RNP的UMSCC104和Fadu HN-SCC细胞进行了XTT增殖实验。同时,使用Turbo-GFP和YAP1 sgRNA作为对照。YAP1是一个诱导癌症干细胞特性的转录因子,在HNSCC中过表达,与SOX2类似,因此被用作高效和高表达编辑的对照。实验结果表明,SOX2基因编辑显著降低了HNSCC细胞的活性。
图二、基因编辑对细胞活性的影响和编辑效率评估
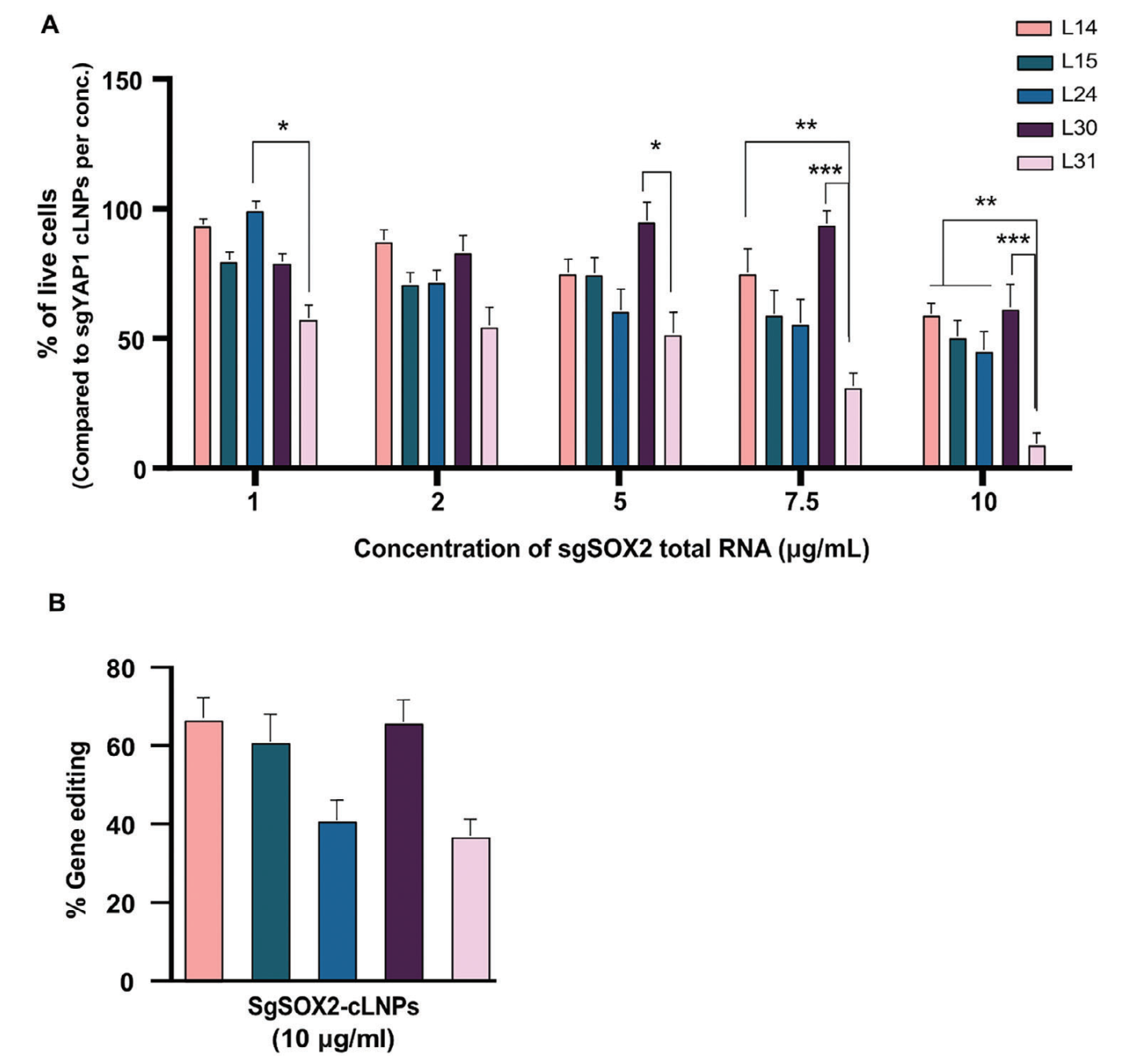
1.3 靶向LNP的表征与基因编辑效率:
我们成功制备了靶向LNPs(tLNPs),并通过透射电子显微镜进行了表征。结果显示,tLNPs具有适当的直径、多分散性指数(PDI)和ζ电位,表明其具有良好的稳定性和分散性。为了确认tLNPs的基因编辑效率,我们进行了基因编辑分析。结果显示,单次治疗tLNPs后,SOX2位点实现了约17%的基因编辑。

图三、靶向LNP的理化性质评价和编辑效率评价
1.4 生物分布与安全性评估:
在体内实验中,我们评估了tLNPs的生物分布。结果显示,tLNPs能够特异性地靶向HNSCC肿瘤,并实现高效的SOX2基因敲除。同时,我们分析了脾脏和肝脏细胞的基因编辑百分比,以确认是否存在脱靶编辑。结果显示,未发现脱靶编辑。此外,我们还评估了tLNPs的免疫原性和毒性。结果显示,SOX2-cLNPs无毒性或免疫原性。
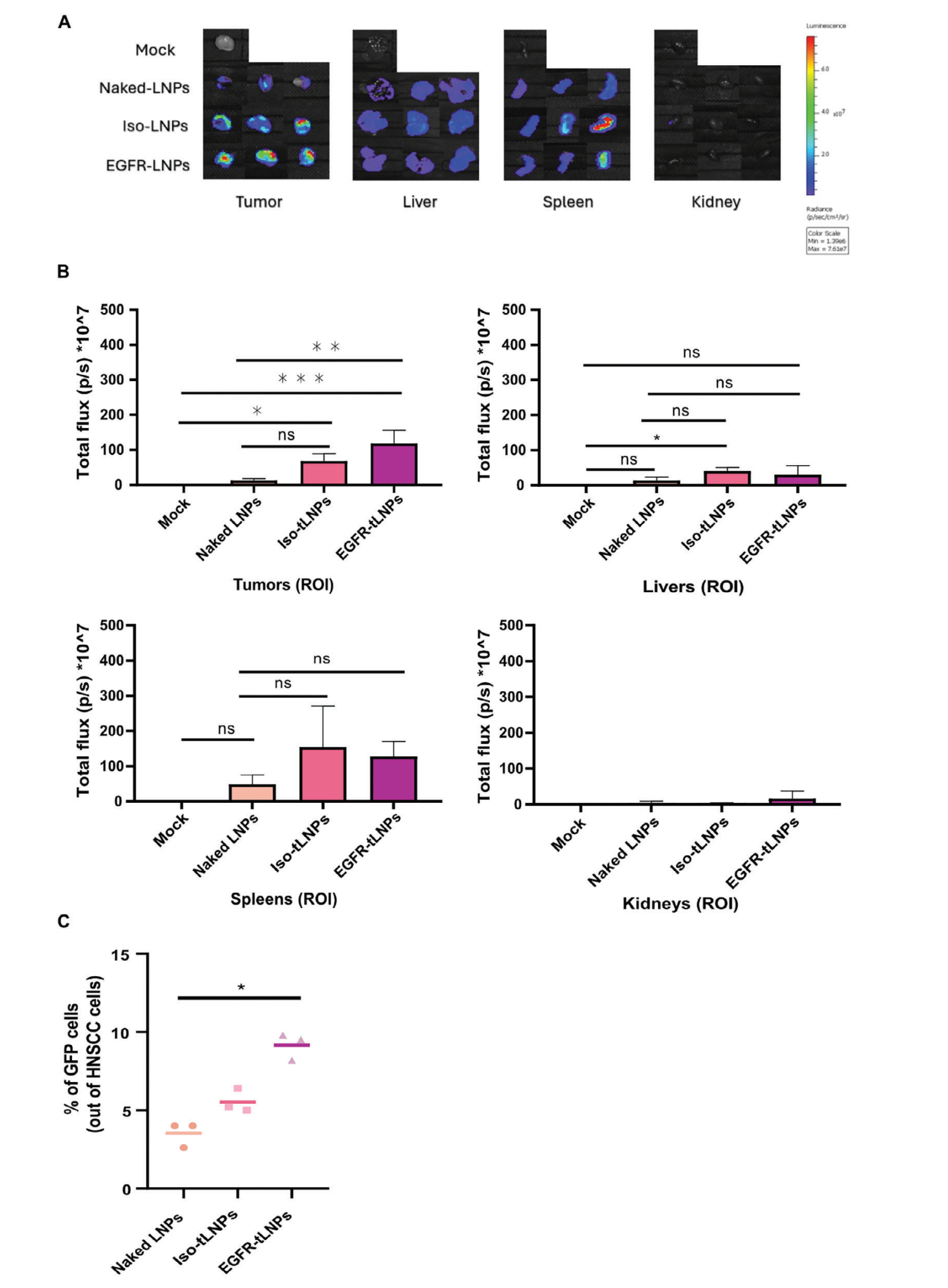
图四、靶向LNP的体内摄取、分布和表达
1.5 靶向tLNPs在HNSCC小鼠模型中的治疗效果:
为了探索靶向tLNPs在体内介导治疗性基因编辑的能力,我们评估了其抑制HNSCC肿瘤生长的效果。我们使用异种移植HNSCC小鼠模型,通过瘤内注射靶向tLNPs。结果显示,与未治疗组相比,靶向tLNPs组实现了90%的肿瘤生长抑制和90%的生存率提高(>84天),且50%的小鼠肿瘤完全消失。这一结果表明,靶向tLNPs能够高效、特异性地靶向HNSCC肿瘤,并实现持久的治疗反应。
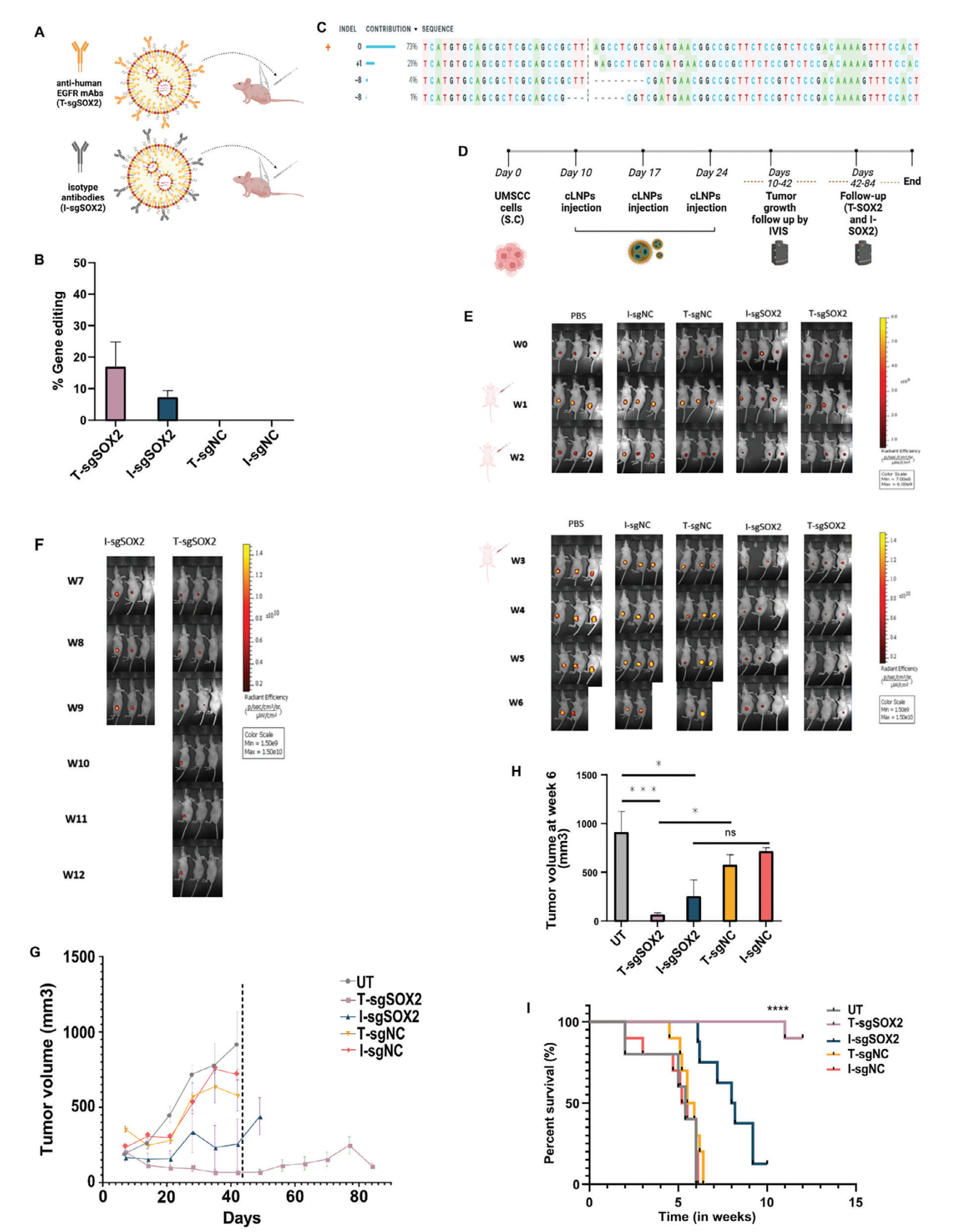
图五、靶向LNP的体内药效评价
参考文献:Masarwy, Razan, et al. "Targeted CRISPR/Cas9 lipid nanoparticles elicits therapeutic genome editing in Head and Neck Cancer." Advanced Science (2024): 2411032.
