021-54281913
癌症治疗中,药物递送系统的靶向性一直是研究的难点和热点。传统的被动靶向依赖于递送系统的物理属性,在肿瘤中的积累受扩散依赖动力学和人体肿瘤生理学变异的限制,临床进展有限。主动靶向则通过在纳米颗粒表面附着特定配体(如糖、肽或抗体)来促进靶细胞摄取,但在体内的应用受到纳米颗粒配方复杂性和生理限制的制约。因此,开发新的靶向策略对于提高癌症治疗的效果至关重要。内源性靶向是一种新兴的靶向机制,它利用体内特定血浆蛋白与纳米颗粒表面结合形成蛋白冠,通过蛋白冠与细胞表面受体的相互作用实现靶向递送。
近日,Daniel J. Siegwart团队在ACS NANO上发表名为“Endogenous Targeting of Lipid Nanoparticles to Kidney Tumors”的研究。该研究假设,通过调控LNPs的物理化学性质,可以使其在静脉注射后吸附特定的血浆蛋白(如Vtn),进而通过Vtn与肾透明细胞癌(ccRCC)细胞表面过表达的αVβ3整合素(Vtn-R)结合,实现LNPs向ccRCC肿瘤的特异性靶向。
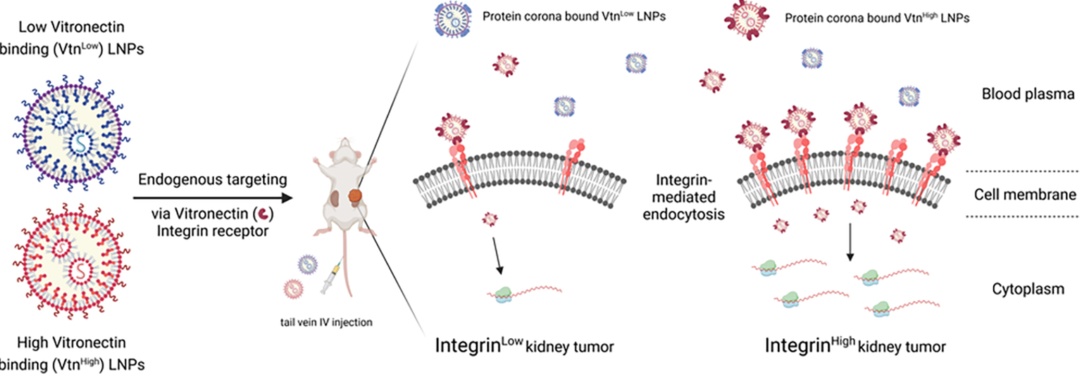
示意图

迈安纳微流控XNano系列设备及试剂盒
2026 TECHNOLOGY
01 实验结果
LNPs的物理化学性质
本研究成功制备了两种LNPs:Vtn Low LNPs和Vtn High LNPs,并通过动态光散射(DLS)、ζ电位测量、表观pKa值测定以及低温电子显微镜(cryo-EM)成像对其物理化学性质进行了全面表征。实验结果显示,Vtn Low LNPs和Vtn High LNPs在水合直径、多分散性指数(PDI)和ζ电位上存在显著差异。
具体而言,Vtn High LNPs表现出较大的水合直径和PDI,同时具有较高的ζ电位绝对值,表明其表面电荷更为密集。通过6-(对甲苯胺基)-2-萘磺酸(TNS)测定,Vtn Low LNPs的表观pKa值约为6.26,而Vtn High LNPs的表观pKa值大于10.26,表明Vtn High LNPs在生理pH条件下具有更强的正电性,有利于与带负电的血浆蛋白结合。此外,cryo-EM成像证实了两种LNPs均呈现球形形态,且大小分布均匀(图1f)。
蛋白冠分析与验证
为了验证Vtn High LNPs对血浆玻连蛋白(Vtn)的富集作用,本研究将Vtn Low LNPs和Vtn High LNPs分别与小鼠血浆孵育,并通过Western blot和质谱分析对其蛋白冠成分进行了检测。
Western blot结果显示,仅在Vtn High LNPs的蛋白冠中检测到Vtn条带,而Vtn Low LNPs的蛋白冠中未检测到Vtn(图1g)。进一步通过质谱分析定量蛋白冠中Vtn的相对丰度,发现Vtn High LNPs的蛋白冠中Vtn丰度是Vtn Low LNPs的167倍(图1h)。这些结果表明,Vtn High LNPs能够高效吸附血浆中的Vtn,形成富含Vtn的蛋白冠。
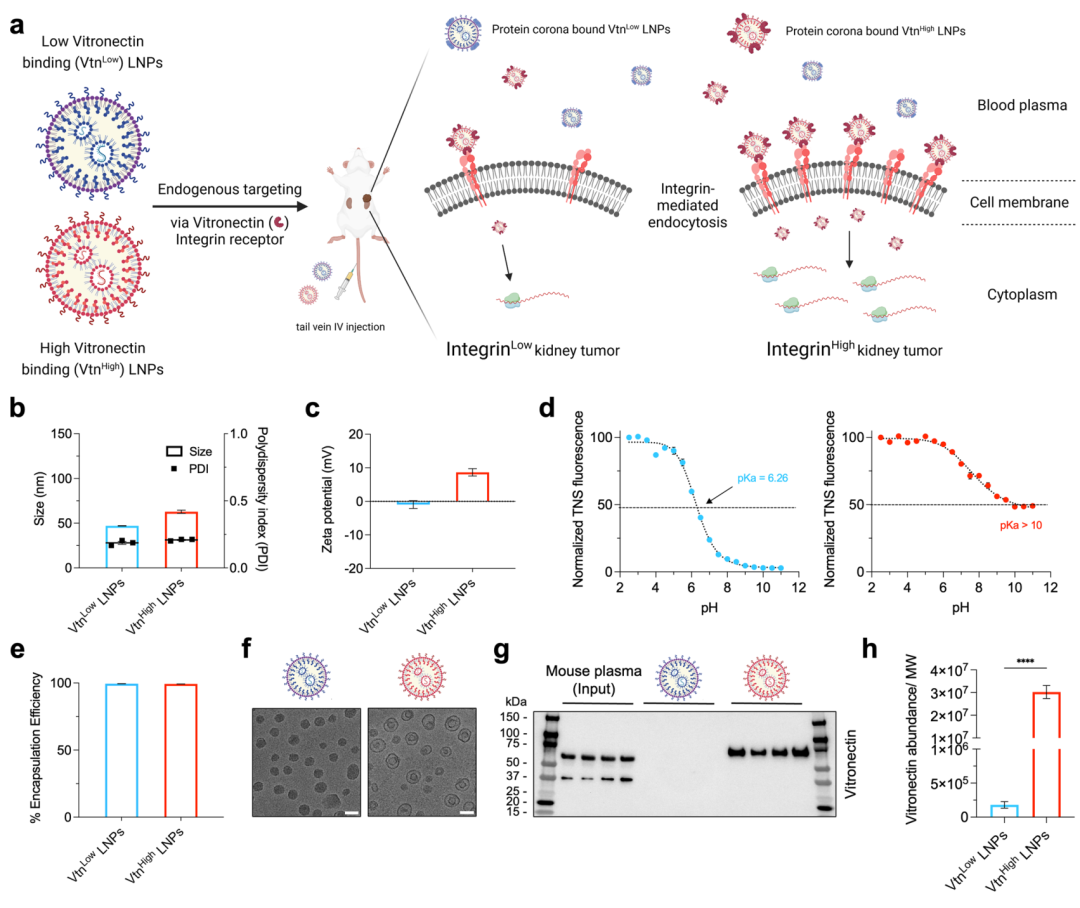
Figure 1. mRNA LNPs with distinct lipid identity showcase preferential binding to the plasma protein ligand vitronectin for enriched uptake in kidney cancer cells.
体外细胞实验
为了评估Vtn Low LNPs和Vtn High LNPs在体外对ccRCC细胞的mRNA递送效率,本研究使用封装荧光素酶mRNA的LNPs处理Integrin Low(XP374)和Integrin High(XP165和XP206)ccRCC细胞,并通过生物发光检测荧光素酶的表达。实验结果显示,在Integrin Low细胞中,Vtn预涂层显著提高了Vtn High LNPs的荧光素酶表达(图2a)。
具体而言,当Vtn预涂层浓度为0.25 g Vtn/g总脂质时,Vtn Low LNPs的荧光素酶表达量略有增加(7倍),而Vtn High LNPs的荧光素酶表达量显著增加(482倍和952倍)。在Integrin High细胞中,Vtn High LNPs的效果进一步提升(952倍)(图2b)。
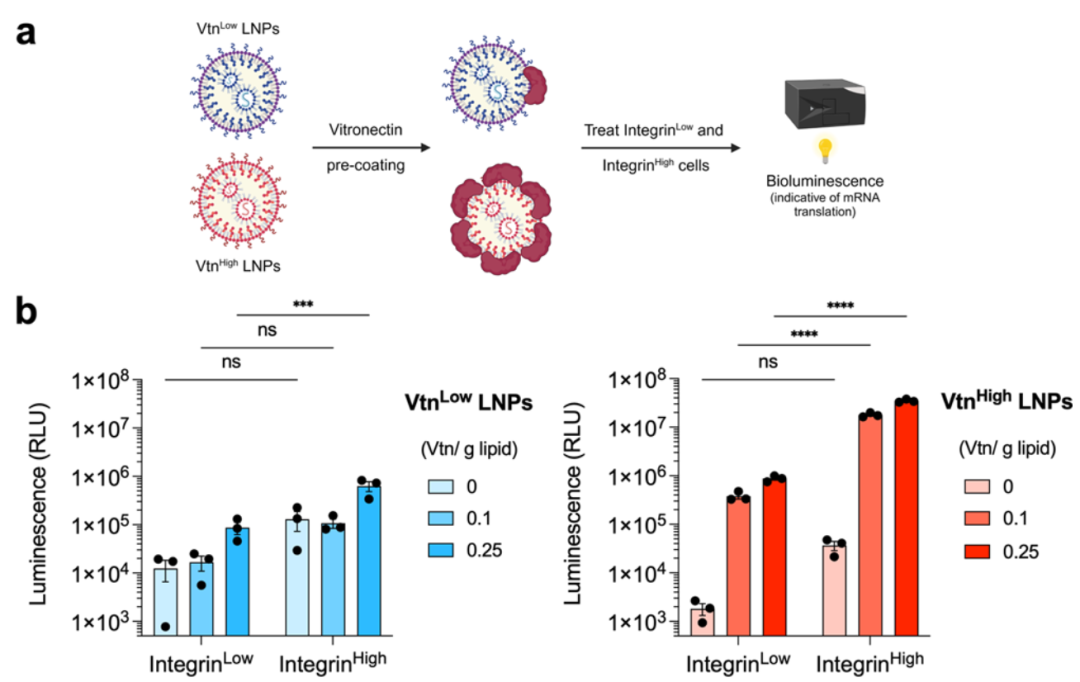
Figure 2. Vitronectin enrichment on VtnHigh LNPs drives cellular uptake and luciferase mRNA delivery in ccRCC cells.
体内动物实验
为了评估Vtn High LNPs在体内的靶向递送效率,本研究建立了患者来源的ccRCC肿瘤异种移植模型(PDX),并通过尾静脉注射封装荧光素酶mRNA的Vtn Low LNPs和Vtn High LNPs。体内成像结果显示,注射后6小时,Vtn High LNPs在肿瘤肾脏中的荧光强度显著高于Vtn Low LNPs(图3a)。
具体而言,在Integrin Low肿瘤中,Vtn High LNPs的荧光强度比Vtn Low LNPs高21.5倍;在Integrin High肿瘤中,Vtn High LNPs的荧光强度比Vtn Low LNPs高41.9倍(图3b)。此外,Vtn High LNPs在肿瘤肾脏中的荧光强度与Vtn和integrin表达水平均呈正相关(图3c)。这些结果表明,Vtn High LNPs能够优先在ccRCC肿瘤中积累,且其效果与Vtn和integrin表达水平正相关。
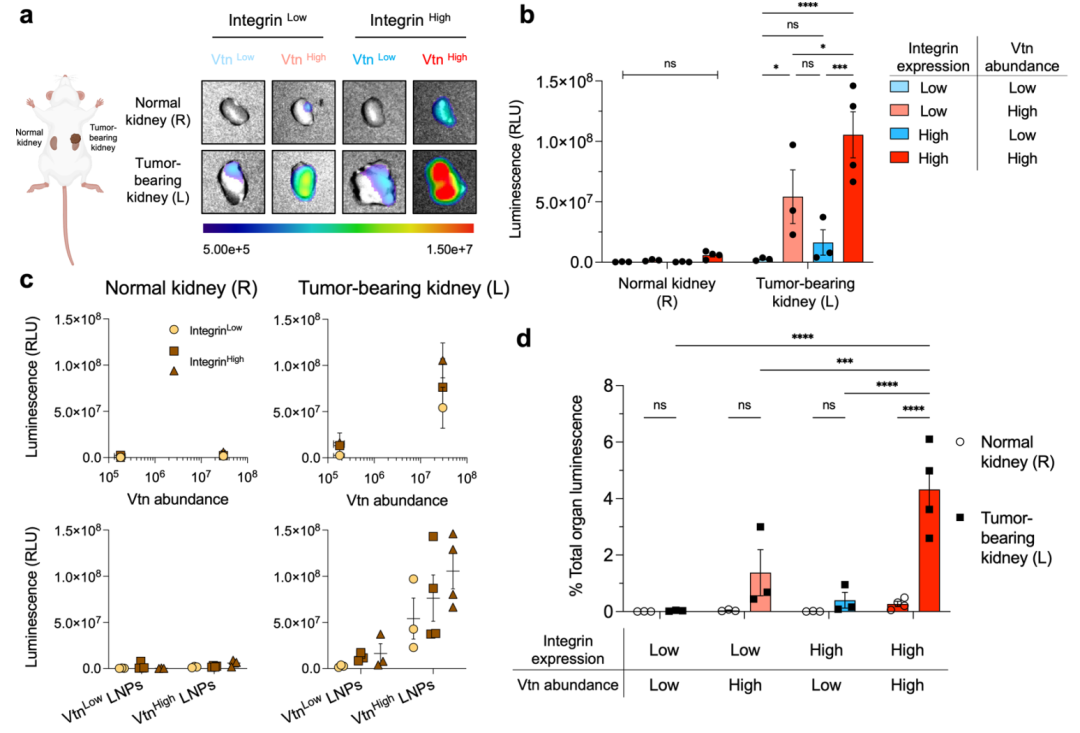
Figure 3. VtnHigh LNPs preferentially target ccRCC tumorgrafts with higher integrin expression.
2026 TECHNOLOGY
02 结论
本研究旨在开发一种内源性靶向策略,通过调控LNPs的物理化学性质,实现静脉注射的mRNA和siRNA向肾透明细胞癌肿瘤的高效递送。研究设计了能够吸附循环血浆玻连蛋白(Vtn)的LNPs,利用Vtn与ccRCC细胞表面过表达的αVβ3整合素)的结合,实现了对ccRCC肿瘤的特异性靶向。体外和体内实验结果表明,该策略显著提高了mRNA和siRNA在ccRCC细胞和肿瘤异种移植模型中的递送效率和功能表达。本研究为癌症纳米医学领域提供了一种新的靶向方法。
迈安纳提供从mRNA合成到LNP制备全流程服务。在RNA技术蓬勃发展的时代,迈安纳致力于为科研客户提供高质量、高效率的mRNA合成服务。我们凭借先进的技术平台和专业的研发团队,为您量身定制精准的mRNA解决方案。
迈安纳的mRNA合成服务优势
高纯度、高完整性:我们采用先进的纯化技术和严格的质量控制流程,确保mRNA纯度超过90%。
合成mRNA保留了RNA分子的完整性和功能活性,为高效翻译奠定基础,下图为体外293T细胞转染与小鼠体内表达结果。
迈安纳提供circRNA合成服务
我们采用先进的环化策略,使circRNA达到环化率>80%,纯度>90%。circRNA较mRNA稳定性更好,能够有效延长半衰期,转染后蛋白质表达水平逐渐升高,但能维持在一个相对稳定的平台期很长一段时间。
多样化修饰与定制化服务
迈安纳提供多种修饰选项,包括加帽、Poly(A)尾巴优化及核苷酸修饰,加帽率>90%,同时支持定制化序列设计,满足蛋白替代疗法、肿瘤疫苗和CAR-T细胞治疗等应用需求。
一站式技术支持
从mRNA设计、合成到递送系统适配,迈安纳提供全流程技术支持与咨询,帮助您优化实验方案并加速研发进程。
迈安纳LNP微流控包封平台

参考文献:Vaidya, Amogh, et al. "Endogenous Targeting of Lipid Nanoparticles to Kidney Tumors." ACS nano (2025).
END