021-54281913
| “脂质纳米颗粒(LNPs)作为mRNA疫苗和治疗性药物的有效递送系统,近年来备受关注。LNP的性质,包括粒径、封装效率和转染效率,受多种因素影响,如混合参数、脂质浓度和水相缓冲液的类型和浓度。” |
|||||
01
|
|||||
| 柠檬酸盐缓冲液因其在酸性条件下(约pH 3至6)具有最佳的缓冲能力而被广泛使用,这有助于使可电离脂质质子化,从而促进其与mRNA的静电相互作用。然而,缓冲液摩尔浓度这一参数往往被忽视。本研究旨在探讨柠檬酸盐缓冲液摩尔浓度对mRNA-LNP物理化学性质、体外和体内转染效率的影响。 | |||||
02
|
|||||
| 2.1 理化特性 | |||||
|
✳ 不同柠檬酸盐缓冲液摩尔浓度下制备的LNP均表现出低的多分散性指数(PDI)和高封装效率。 ✳ 使用DLS和NTA测量粒径时,发现随着柠檬酸盐缓冲液摩尔浓度的增加,LNP的z-average直径和NTA模式下的粒径均略有增加(约5-10nm)。 ✳ 柠檬酸盐缓冲液摩尔浓度的变化对LNP的PDI和Zeta电位无显著影响。 ✳ 透射电子显微镜(TEM)图像显示,随着柠檬酸盐缓冲液摩尔浓度的增加,LNP的形态趋向于形成更多的囊泡状结构(bleb结构)。 |
|||||
 |
|||||
| 不同制备条件LNP的粒径和pKa变化 |
|||||
 |
|||||
| 不同制备条件LNP的形态变化 | |||||
| 2.2 细胞摄取 | |||||
|
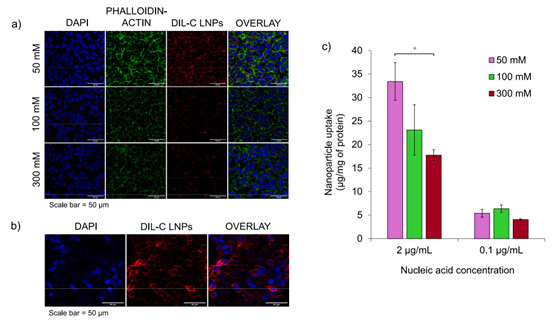
✳ 定性和定量细胞摄取实验表明,使用50mM柠檬酸盐缓冲液制备的LNP在HEK293细胞中的摄取量相对较高。 ✳ 相比之下,使用300mM柠檬酸盐缓冲液制备的LNP的细胞摄取量显著降低。 |
|||||
 |
|||||
| 不同制备条件LNP的细胞摄取结果 | |||||
| 2.3 体外转染效率 | |||||
|
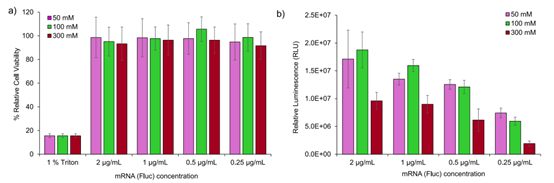
✳ 荧光素酶测定结果显示,使用50mM和100mM柠檬酸盐缓冲液制备的LNP在体外转染效率上无显著差异。 ✳ 然而,使用300mM柠檬酸盐缓冲液制备的LNP的体外转染效率较低。 |
|||||
 |
|||||
| 不同制备条件LNP的细胞毒性和细胞表达结果 | |||||
| 2.4 体内性能 | |||||
|
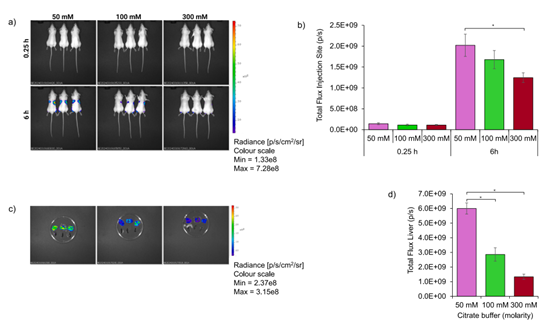
✳ 活体成像结果显示,注射使用50mM和100mM柠檬酸盐缓冲液制备的LNP的小鼠在注射部位的荧光素酶表达水平相似。 ✳ 相比之下,注射使用300mM柠檬酸盐缓冲液制备的LNP的小鼠在注射部位的荧光素酶表达水平较低。 ✳ 此外,在肝脏中也观察到了荧光素酶的表达,且使用50mM柠檬酸盐缓冲液制备的LNP的表达水平显著高于使用100mM和300mM柠檬酸盐缓冲液制备的LNP。 |
|||||
 |
|||||
| 不同制备条件LNP的体内表达结果 | |||||
03
|
|||||
|
本研究表明,柠檬酸盐缓冲液摩尔浓度对mRNA-LNP的制备具有重要影响。尽管摩尔浓度的变化对LNP的平均粒径无显著影响,但在更详细的粒径和形态分析中发现了微妙差异。此外,高摩尔浓度的柠檬酸盐缓冲液显著降低了细胞的内在化和体外转染效率,这一趋势在体内实验中也得到了验证。这些结果提示,在制备mRNA-LNP时,需要仔细考虑柠檬酸盐缓冲液的浓度以及其与脂质成分的相互作用。 |
|||||
|
参考文献:Binici, Burcu, et al. "The influence of citrate buffer molarity in mRNA-LNPs: exploring factors beyond general critical quality attributes." International Journal of Pharmaceutics (2024): 124942. |
|||||