产品
服务
联系我们
400-021-7882
021-54281913
021-54281913
| “造血干细胞(HSCs)是血液系统中的多功能干细胞,负责产生所有类型的血细胞。它们在多种血液疾病和免疫疾病治疗中具有重要应用,包括遗传性血液疾病、某些类型的癌症以及免疫系统疾病。因此,开发一种能够精确递送治疗性mRNA到HSCs的方法对于基因治疗领域具有重大意义。在基因治疗领域,精确的mRNA递送技术是实现基因疗法的关键。” | |||||
01
|
|||||
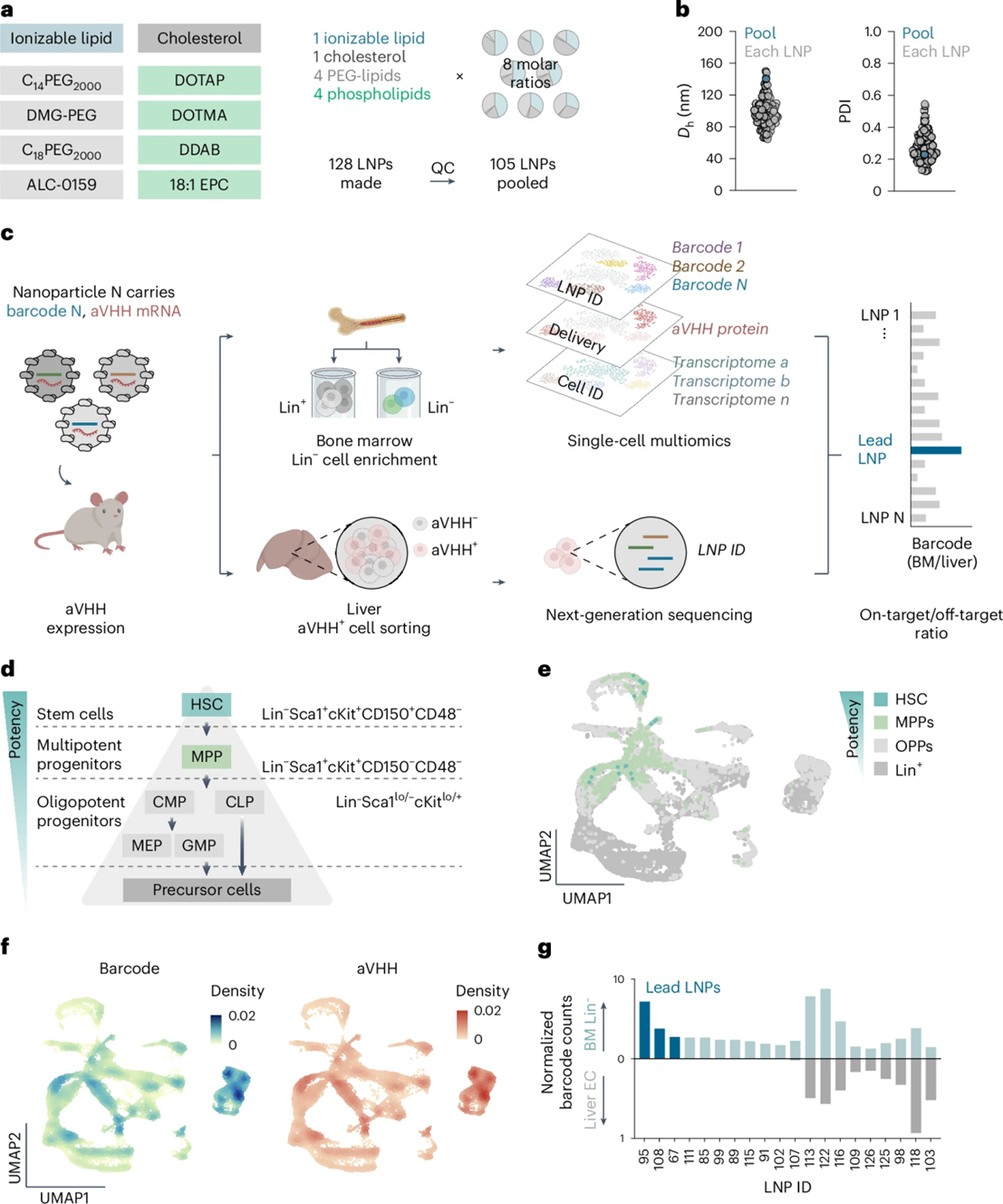
| 最近,佐治亚理工学院库尔特生物医学工程系的James E. Dahlman教授领导的研究团队在《Nature Biotechnology》杂志上发表了一篇具有里程碑意义的论文,介绍了一种新型脂质纳米颗粒(LNP)——LNP67,它能够在无需骨髓动员或化疗调理的情况下,将mRNA有效递送到小鼠和恒河猴体内的造血干细胞(HSC)和造血干/祖细胞(HSPC)。 | |||||
02
|
|||||
| LNP67的开发是基于对105种不同LNP的高通量筛选,这些LNP在小鼠模型中进行了测试,以评估它们对骨髓的趋向性。筛选结果显示,LNP67在骨髓与肝脏的递送比例上表现最佳,表明其对骨髓细胞具有高度的选择性。如图1所示,LNP67在骨髓中的递送效率远高于肝脏,这一特性使其成为HSC基因治疗的理想候选者。 | |||||
 |
|||||
| 带有条形码的LNPs在体内将mRNA递送至转录定义的HSCs | |||||
03
|
|||||
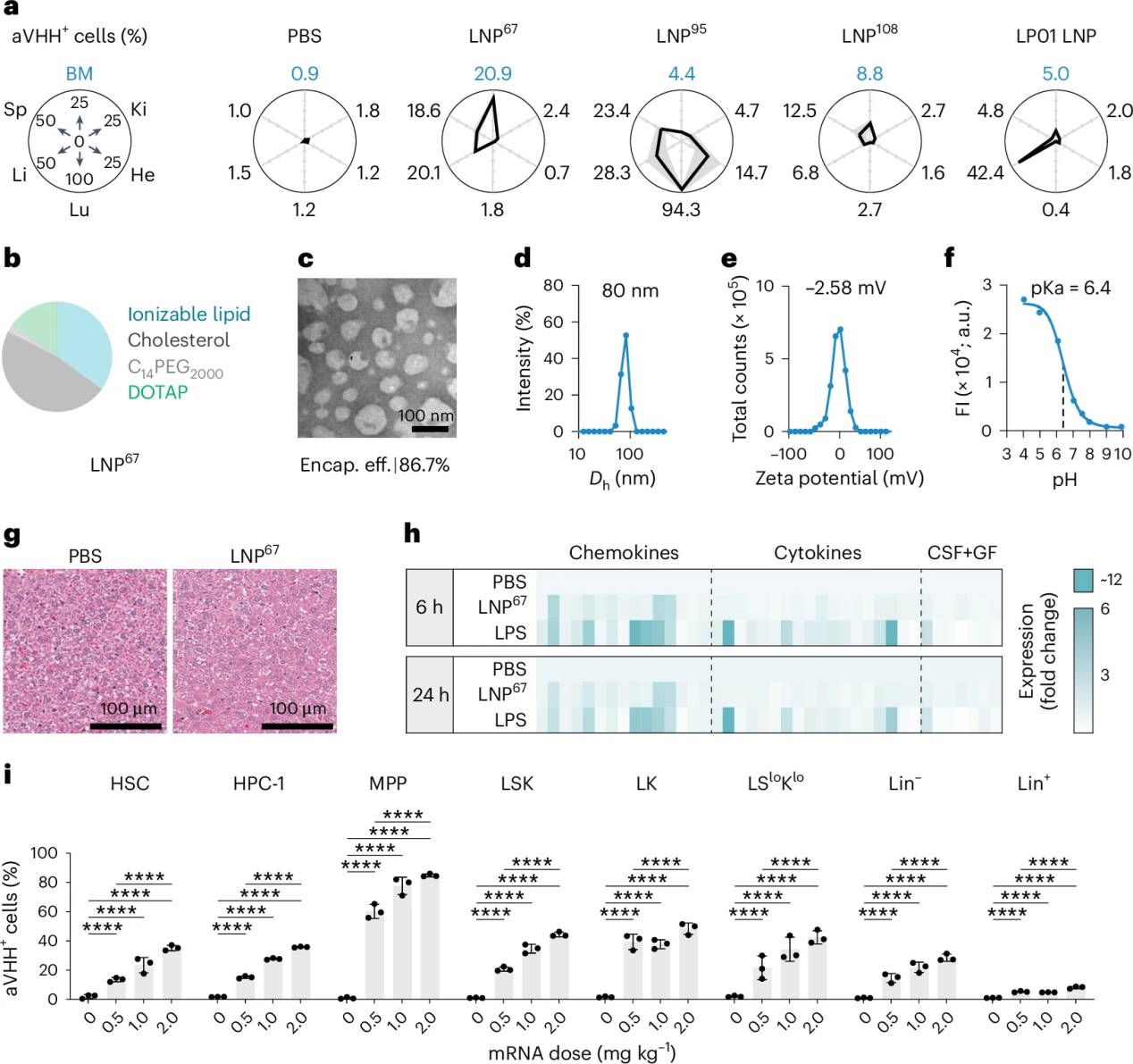
| 3.1 LNP67的物理特性和稳定性 | |||||
| LNP67的物理特性如图2所示,其形成了直径约为80纳米的球形颗粒,具有-2.6 mV的zeta电位和6.4的pKa值。通过冷冻透射电子显微镜(cryo-TEM)分析,研究团队发现LNP67具有固体核心,与肝脏靶向的LNP(LP01)相比,具有相似的平均圆形度和直径。这些数据不支持明显的生物物理变化影响LNP67的趋向性。 | |||||
 |
|||||
| LNP67 将mRNA 递送至小鼠骨髓细胞 | |||||
| 3.2 LNP67在体内将mRNA递送至转录定义的HSCs | |||||
| 在体内递送mRNA至特定的细胞类型一直是一个挑战,因为需要克服多种生物学障碍,包括血液循环、细胞膜的穿透以及细胞内mRNA的释放。如图3所示,LNP67纳米颗粒的选择性使得它能够在不损害其他细胞的情况下,将mRNA直接递送到HSCs。 | |||||
|
|
|||||
| LNP67在体内向转录定义的HSCs递送mRNA | |||||
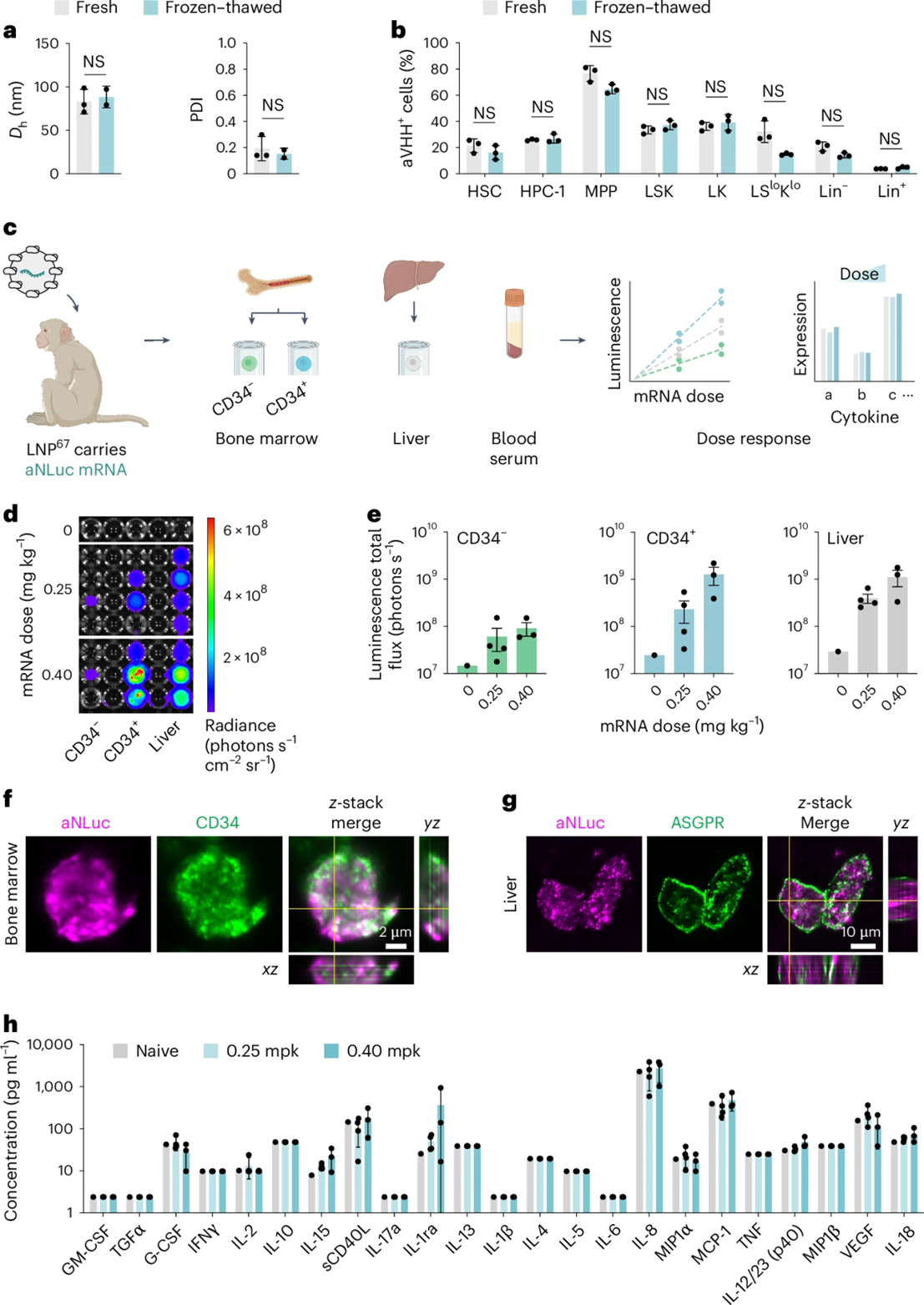
| 3.3 LNP67的体内递送效率 | |||||
| 研究团队进一步评估了LNP67在恒河猴体内的递送效率。如图4所示,LNP67能够在0.25和0.4 mg/kg的剂量下,将mRNA递送到恒河猴的CD34+细胞,显示出与肝脏递送相当的效果。此外,LNP67在冷冻-解冻周期后仍能保持其物理稳定性和递送效率,这对于临床应用中的物流和存储具有重要意义。 |
|||||
 |
|||||
| LNP67 将mRNA 递送至恒河猴的CD34+ 细胞 | |||||
| 3.4 LNP67的安全性和耐受性 | |||||
| 在恒河猴中进行的研究表明,LNP67在研究剂量下具有良好的耐受性,未观察到显著的不良反应。如图4h所示,与对照组相比,LNP67处理的动物在血清细胞因子水平上没有显著差异,这为LNP67的临床应用提供了安全性数据支持。 | |||||
| 3.5 LNP67的临床潜力和未来方向 | |||||
| LNP67的成功研发为基因治疗提供了一种新的工具,尤其是在治疗镰状细胞病、β-地中海贫血、贫血、免疫缺陷和代谢紊乱等与HSC功能障碍相关的疾病方面具有巨大潜力。如图5所示,LNP67在体外对人类原代HSC的递送效率也显示出剂量依赖性,这进一步证实了其临床应用的潜力。 | |||||
|
|
|||||
| LNP67在体外向人HSCs递送mRNA | |||||
04
|
|||||
| 在小鼠模型中,LNP67显示出对骨髓的高度选择性。如图2a所示,LNP67在骨髓细胞中的递送效率远高于肝脏细胞。研究还发现,LNP67的物理特性,如图2c-e所示,其球形颗粒的流体动力学直径为80纳米,zeta电位为-2.6 mV,pKa值为6.4,这些特性对于其在体内的稳定性和递送效率至关重要。
|
|||||
| 参考文献:Kim H ,Zenhausern R ,Gentry K , et al.Lipid nanoparticle-mediated mRNA delivery to CD34+ cells in rhesus monkeys[J].Nature Biotechnology,2024,(prepublish):1-8. | |||||